题目内容
1.为了探究过氧化納与浓盐酸反应的产物,某研究性学习小组设计了如图所示的实验装置.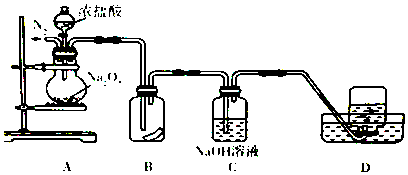
回答下列问题:
(1)实验开始前,必须进行的实验操作是检查装置气密性、缓慢通入一定量的N2后,将装置D连接好.
(2)实验过程中装置B中湿润的有色布条褪色,说明生成的气体中有Cl2生成,说明Na2O2有氧化性.
(3)装置C的主要作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O、H++OH-═H2O.
(4)为证明装置D中收集到的无色气体是氧气,应进行的实验操作是用一根带火星的木条插入集气瓶中,发现木条复燃,就证明是氧气.
(5)过氧化钠与浓盐酸发生反应的化学方程式3Na2O2+6HCl=6NaCl+4H2O+O2↑+Cl2↑.
分析 探究过氧化钠与浓盐酸反应的产物,A装置:过氧化钠与浓盐酸反应,B装置:利用氯水的漂白性探究装置A中是否有Cl2生成,C装置:吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气,D装置:收集到较为纯净的氧气.实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器.
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,有气体产生.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置D中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
(1)有气体参加或生成的反应,为保证反应顺利进行需进行气密性的检查,该实验产物中有氧气需验证,为防止空气干扰实验,需排尽装置中的空气;
(2)氯气和水反应生成HClO,HClO有漂白性;处于最低价的元素只有还原性,化合价升高被氧化;
(3)Cl2有毒不能直接排空,如果O2中混有Cl2,会导致收集的O2不纯净;
(4)氧气具有助燃性,用带火星的木条检验;
(5)过氧化钠与盐酸反应氧化还原反应生成氯化钠、氯气、氧气和水.
解答 解:(1)探究过氧化納与浓盐酸反应的产物,可能有O2、Cl2生成,要使反应顺利进行,需保证整套装置的气密性良好,该实验产物中有氧气需验证,为防止空气干扰实验,需排尽装置中的空气,D装置:收集到较为纯净的氧气,所以需缓慢通入一定量的N2后,将装置D连接好,
故答案为:检查装置气密性;缓慢通入一定量的N2后,将装置D连接好;
(2)湿润的红色石蕊试纸褪色,说明有HClO生成,氯气和水反应生成HClO,所以说明装置A中有Cl2生成;氯化氢中-1价的氯只有还原性,过氧化钠与浓盐酸反应,生成的气体中有氯气,氯元素的化合价从-1价变为0价,被氧化,说明过氧化钠具有氧化性,
故答案为:Cl2;氧化;
(3)Cl2有毒不能直接排空,如果O2中混有Cl2,会导致收集的O2不纯净,且盐酸具有挥发性,导致生成的气体中含有HCl,氯气、HCl都能和NaOH反应而除去,离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,H++OH-═H2O,则NaOH的作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气,
故答案为:吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气;Cl2+2OH-═Cl-+ClO-+H2O、H++OH-═H2O;
(4)氧气具有助燃性,是用一根带火星的木条插入集气瓶中,发现木条复燃,就证明是氧气,
故答案为:用一根带火星的木条插入集气瓶中,发现木条复燃,就证明是氧气;
(5)过氧化钠与浓盐酸发生反应,氯化氢被氧化成氯气,反应为3Na2O2+6HCl=6NaCl+4H2O+O2↑+Cl2↑,
故答案为:3Na2O2+6HCl=6NaCl+4H2O+O2↑+Cl2↑.
点评 本题考查性质实验探究,侧重考查学生分析问题能力,物质的性质是实验设计的依据,性质、制备实验方案设计是高考高频点,综合性较强,涉及知识点较多,熟练掌握元素化合物知识,题目难度中等.

| A. | 铝比铁化学性质活泼 | |
| B. | 铝表面有一层致密氧化膜起保护作用 | |
| C. | 铝性质太活泼已经全部被氧化成了氧化铝 | |
| D. | 铁有可能只失去二个电子而铝失三个电子,从而比铝更容易被氧化 |
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 一学生用pH试纸测得某氯水的pH为2 | |
| C. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| D. | 配制硫酸亚铁溶液,是将晶体溶于蒸馏水再加入一定量的铁粉 |
| A. | 称取7.68gCuSO4加水配成480mL溶液 | |
| B. | 称取12.5g 胆矾,加水配成500mL溶液 | |
| C. | 称取8.0CuSO4,加水500mL 溶解配成溶液 | |
| D. | 称取12.0g胆矾,加水480mL溶解配成溶液 |
| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
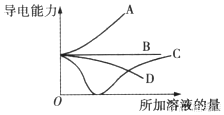
| A. | 曲线A表示NaOH溶液中滴加稀盐酸 | |
| B. | 曲线B表示CH3COOH溶液中滴加KOH溶液 | |
| C. | 曲线C表示Ba(OH)2溶液中滴加稀硫酸 | |
| D. | 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液 |
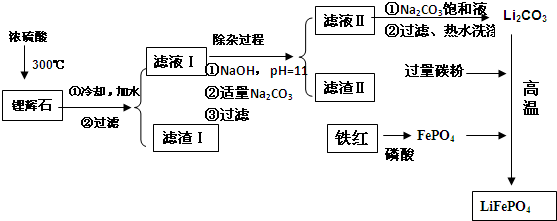
已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
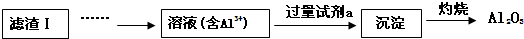
(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式)
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
(5)磷酸亚铁锂电池总反应为:FePO4+Li $?_{充电}^{放电}$ LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:FePO4+Li++e-=LiFePO4.若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况、产生时,该电池消耗锂的质量为1.4g.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中所列元素中,最活泼的金属元素是Na(填元素符号,下同),最活泼的非金属元素是F.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式,下同),碱性最强的是NaOH,呈两性的是Al(OH)3.
 ,AC2的电子式
,AC2的电子式