题目内容
11.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:a、2NO(g)+Cl2(g)?2ClNO(g)△H1<0 其平衡常数为K1
b、2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H2<0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H3的平衡常数K=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$(用K1、K2表示).△H3=2H2-△H1(用△H1、△H2表示).
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡.测得10min内υ(ClNO )=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=0.025mol,NO的转化率a1=75%.
其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为a2,a1<a2(填“>”“<”或“=”),平衡常数K1不变(填“增大”“减小”或“不变”).若要使K1减小,可采用的措施是升高温度.
分析 (1)已知:a、NO(g)+Cl2(g)?2ClNO(g),
b、2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
根据盖斯定律,b×2-a可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为b平衡常数平方与a的商;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式计算参加反应NO、氯气的物质的量,进而计算平衡时氯气的物质的量、NO的转化率;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应a在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动;
平衡常数只受温度影响,温度不变,平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小.
解答 解:((1)已知:a、NO(g)+Cl2(g)?2ClNO(g),
b、2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
根据盖斯定律,b×2-a可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$,则△H3=2H2-△H1,
故答案为:$\frac{{{K}_{2}}^{2}}{{K}_{1}}$;2H2-△H1;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,
由方程式可知,参加反应氯气的物质的量为0.15mol×$\frac{1}{2}$=0.075mol,故平衡时氯气的物质的量为0.1mol-0.075mol=0.025mol;
参加反应NO物质的量为0.15mol,则NO的转化率为$\frac{0.15mol}{0.2mol}$×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,a在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α1<α2;
平衡常数只受温度影响,温度不变,平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,
故答案为:0.025;75%;<;不变;升高温度.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、盖斯定律应用等知识,为高考常见题型,充分考查学生的分析理解能力,需要学生具备扎实的基础与灵活应用能力,难度中等.

 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
(1)写出碳酸的第一级电离平衡常数表达式:Ka1=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$.
(2)物质的量浓度均为0.1mol/L的六种溶液:
a.CH3COONa、b.Na2CO3、c.NaClO、d.NaHCO3、e.NaSCN f.NaCN
pH由大到小的顺序为b>f>c>d>a>e(用编号填写).
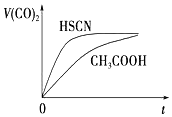
(3)25℃时,将20mL0.1mol•L-1CH3COOH溶液和20mL0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示.反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中
c(Na+)-c(CN-)=10-6-10-8mol/L(填代入数据后的计算式,不必算出具体数值).$\frac{c(C{N}^{-})}{c(HCN)}$=$\frac{6.2×1{0}^{-10}}{1{0}^{-8}}$ (填代入数据后的计算式,不必算出具体数值).
(5)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
(6)25C时,0.18mol/L醋酸钠溶液的PH约为9.
| A. | 称取7.68gCuSO4加水配成480mL溶液 | |
| B. | 称取12.5g 胆矾,加水配成500mL溶液 | |
| C. | 称取8.0CuSO4,加水500mL 溶解配成溶液 | |
| D. | 称取12.0g胆矾,加水480mL溶解配成溶液 |

| A. | 曲线A表示NaOH溶液中滴加稀盐酸 | |
| B. | 曲线B表示CH3COOH溶液中滴加KOH溶液 | |
| C. | 曲线C表示Ba(OH)2溶液中滴加稀硫酸 | |
| D. | 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液 |
已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
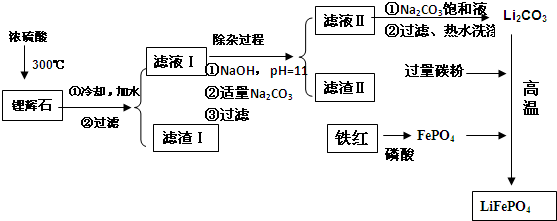
(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式)
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
(5)磷酸亚铁锂电池总反应为:FePO4+Li $?_{充电}^{放电}$ LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:FePO4+Li++e-=LiFePO4.若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况、产生时,该电池消耗锂的质量为1.4g.
| A. | Na和O2 | B. | Cu和HNO3 | C. | Na2O2和CO2 | D. | AlCl3和NaOH |
| A. | 苯 | B. | 甲烷 | C. | 乙烯 | D. | 乙酸 |

 ,AC2的电子式
,AC2的电子式
