题目内容
13.现有下列4种物质:①SiO2、②稀HNO3、③浓H2SO4、④Na2SiO3.其中,不溶于水的是①(填序号,下同);能使蔗糖变黑的是③;能与盐酸反应产生白色胶状物质的是④;能与Cu反应生成NO的是②.分析 结合物质的性质进行判断,四种物质中,二氧化硅不溶于水,浓硫酸具有脱水性,盐酸的酸性强于硅酸,应用强酸制弱酸生成白色胶状物质硅酸,稀硝酸具有强氧化性,与金属铜反应生成一氧化氮气体,以此解答.
解答 解:二氧化硅不溶于水;浓硫酸具有脱水性,能使蔗糖变黑;盐酸的酸性强于硅酸,能与盐酸反应产生白色胶状物质;Cu与稀硝酸反应生成NO,
故答案为:①;③;④;②.
点评 本题综合考查元素化合物知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列为周期表的一部分,据此回答下列有关问题:
(1)写出元素符号:①N,⑤Mg,⑦Si,⑧S.
(2)表中所列元素中,最活泼的金属元素是Na(填元素符号,下同),最活泼的非金属元素是F.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式,下同),碱性最强的是NaOH,呈两性的是Al(OH)3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中所列元素中,最活泼的金属元素是Na(填元素符号,下同),最活泼的非金属元素是F.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式,下同),碱性最强的是NaOH,呈两性的是Al(OH)3.
1.能与碳酸钠溶液反应产生气体的物质是( )
| A. | 苯 | B. | 甲烷 | C. | 乙烯 | D. | 乙酸 |
8.下列解释实验事实的离子方程式正确的是( )
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |
5.钠与水反应时的现象中与钠的下列性质无关的是( )
| A. | 钠的熔点低 | B. | 钠的密度小 | C. | 钠的硬度小 | D. | 有强还原性 |
2.用锌,氧化铜,稀硫酸作原料制取铜时,有下列两种途径:
(1)锌$\stackrel{稀硫酸}{→}$ 氢气$\stackrel{氧化铜}{→}$ 铜
(2)氧化铜$\stackrel{稀硫酸}{→}$ 硫酸铜 $\stackrel{锌铜}{→}$
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
(1)锌$\stackrel{稀硫酸}{→}$ 氢气$\stackrel{氧化铜}{→}$ 铜
(2)氧化铜$\stackrel{稀硫酸}{→}$ 硫酸铜 $\stackrel{锌铜}{→}$
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
| A. | 消耗相同质量的硫酸 | B. | 消耗相同质量的锌 | ||
| C. | 消耗相同质量的氧化铜 | D. | 生成的硫酸锌质量相同 |
3.下列有关说法正确的是( )
| A. | 镀锡铁制品镀层破损后铁不易被腐蚀 | |
| B. | 相同温度下,pH相同的盐酸和硫酸中水的电离程度相同 | |
| C. | 向饱和石灰水中滴加少量CuC12溶液出现蓝色沉淀,则Ksp[Ca(OH)2]<Ksp[Cu(OH)2] | |
| D. | 合成氨生产中,需将NH3液化分离,目的是加快正反应速率,并提高H2转化率 |
 ,AC2的电子式
,AC2的电子式
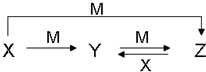
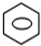 +HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$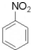 +H2O.
+H2O.