题目内容
17.为检验溶液中是否含有Cl-,常采用向溶液中先加HNO3,再加AgNO3溶液的实验方案,若有白色沉淀生成,则证明有Cl-.对此结论,有人提出了质疑,设计了如表探究性实验.实验一:向Na2SO4溶液中滴加AgNO3溶液
| 编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积 | 浓度/(mol•L-1) | ||
| ① | 1 | 1 | 3滴 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3滴 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3滴 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3滴 | 0.01 | 无明显变化 |
(2)学生设计了如表表格,对实验一内容进行理论计算,请帮他完成表格.(表中不要留空格).
| 编号 | AgNO3浓度/(mol•L-) | 稀释后Ag+浓度/(mol•L-1) | 混合溶液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.01 | 0.12 |
| ④ | 0.01 | 0.001 |
A.混合液中c(SO42-)=0.1 mol•L-1 时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1 mol•L-1 时不会产生Ag2SO4沉淀
C.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol•L-1 AgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)某同学在实验一的基础上继续设计了以下实验.
实验二:
| 编号 | AgNO3浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
假设一:H+对Ag2SO4起溶解作用.
假设二:NO3-对Ag2SO4溶解起作用.
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立.请补齐实验方案(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体).
①取少量CaSO4固体于试管中,加入一定量浓HNO3,充分振荡.若沉淀溶解,说明假设一成立.
②取少量Ag2SO4固体于试管中,加入一定量NaNO3饱和溶液,充分振荡.若沉淀溶解,说明假设二成立说明假设二成立.
(5)通过(4)的实验发现假设一成立,请用平衡理论解释Ag2SO4溶解的原因Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),H+与SO42-结合生成HSO4-,SO42-浓度降低,平衡正向移动,Ag2SO4不断溶解.
结论:该同学组通过实验发现,考虑到Ag+对Cl-检验的灵敏度较高,通常情况下,实验室配制的用来检验Cl-的AgNO3浓度一般较小,所以SO42-对Cl-检验的干扰是完全可以排除的.
分析 (1)向Na2SO4溶液中滴加AgNO3溶液,出现白色沉淀,说明生成硫酸银,据此书写离子反应方程式;
(2)依据表格得知四次实验中AgNO3浓度/(mol•L-1)依次减小,对比稀释后Ag+浓度/(mol•L-1),应为稀释10倍,依据Ksp(Ag2SO4)=1.2×10-5,填写实验④中混合液中SO42-的最小理论检出浓度/(mol•L-1);依据溶度积常数判断是否产生沉淀;
(3)硝酸中存在氢离子和硝酸根,从这两种离子对银离子的影响假设即可;
(4)若稀硝酸能溶解硫酸该固体,则说明假设一成立;若硝酸钠能使硫酸银溶解,说明假设二成立,据此解答即可;
(5)Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),加入氢离子,氢离子与硫酸根结合,据此判断即可.
解答 解:(1)硫酸银为微溶于水的白色沉淀,故硫酸钠中滴入硝酸银生成白色沉淀的离子反应方程式为:2Ag++SO42-═Ag2SO4↓,
故答案为:2Ag++SO42-═Ag2SO4↓;
(2)对比实验①③得知,应为稀释10倍,故②中银离子浓度为:0.5÷10=0.05mol/L; ④中稀释后硝酸银浓度为0.001mol/L;由于25℃时Ksp(Ag2SO4)=1.2×10-5,故混合液中SO42-的最小理论检出浓度/(mol•L-1)=$\frac{{K}_{SP}(A{g}_{2}S{O}_{4})}{{c}^{2}(A{g}^{+})}$=$\frac{1.2×1{0}^{-5}}{(1×1{0}^{-3})^{2}}$=12;
向l mL某溶液中加入3滴0.1mol/L AgNO3溶液;
A.依据实验③得出此种银离子浓度下,当c(SO42-)>0.12mol/L时才产生Ag2SO4沉淀,故A正确;
B.混合液中c(SO42-)=1mol/L时会产生Ag2SO4沉淀,故B错误;
C.依据AB可知,硫酸根离子达到一定程度,会产生硫酸银沉淀,故C错误;
D.由此实验得出若使用0.01mol/L AgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰,故D正确,符合要求的为AD,
故答案为:0.05;12;AD;
(3)硝酸只能电离出氢离子和硝酸根,结合题意假设二为:NO3-对Ag2SO4溶解起作用,据此得出:假设一:H+对Ag2SO4溶解起作用,
故答案为:H+对Ag2SO4溶解起作用;
(4)结合所给的试剂,若硝酸钠能使硫酸银溶解,说明假设二成立,设计实验为:取少量Ag2SO4固体于试管中,加入一定量NaNO3饱和溶液,充分振荡.若沉淀溶解,说明假设二成立,
故答案为:取少量Ag2SO4固体于试管中,加入一定量NaNO3饱和溶液,充分振荡.若沉淀溶解,说明假设二成立;
(5)Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),H+与SO42-结合生成HSO4-,SO42-浓度降低,平衡正向移动,Ag2SO4不断溶解,
故答案为:Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),H+与SO42-结合生成HSO4-,SO42-浓度降低,平衡正向移动,Ag2SO4不断溶解.
点评 本题主要考查的是沉淀溶度积常数的应用,涉及离子反应方程式的书写、实验方案的设计与评价等,综合性较强,题目难度中等.

| A. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| B. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)═c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
| A. | 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| B. | 西非国家曾爆发埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 硅胶可用作食品干燥剂 | |
| D. | 燃料脱硫,脱氮都是减少酸雨的有效措施 |
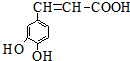
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3 mol CO32- |
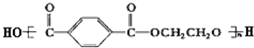
| A. | 合成涤纶纤维的单体为HOCH2CH2OH和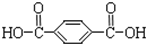 | |
| B. | 棉花和涤纶纤维在一定条件下均能水解 | |
| C. | 涤纶纤维和棉花均为混合物 | |
| D. | 棉花和涤纶纤维不能用燃烧法区别 |
| A. | FeCl3易溶于水 | B. | 液态的FeCl3不导电 | ||
| C. | FeCl3常温下不易分解 | D. | FeCl3溶于水能电离,呈酸性 |
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 |
