题目内容
12.已知咖啡酸的结构如图所示.关于咖啡酸的描述正确的是( )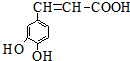
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3 mol CO32- |
分析 该物质中含有酚羟基、碳碳双键和羧基,具有酚、烯烃和羧酸性质,能发生取代反应、显色反应、氧化反应、加成反应、加聚反应、酯化反应等,据此分析解答.
解答 解:A.该芳香族化合物有三个取代基,分别为两个酚羟基、一个-CH=CH-COOH,与该有机物符合条件的异构体为官能团在苯环上的位置不同,分别为: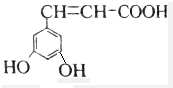 、
、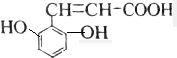 、
、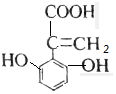 、还有与两羟基为间位关系的,另外也可以苯环上连有四个基团的,又有些种,共有6种,故A错误;
、还有与两羟基为间位关系的,另外也可以苯环上连有四个基团的,又有些种,共有6种,故A错误;
B.该分子中含有羧基和羟基,能发生缩聚反应生成高分子化合物,故B错误;
C.碳碳双键、苯环能和氢气在一定条件下发生加成反应,则咖啡酸最多可与4mol氢气发生加成反应,故C错误;
D.羧基能和碳酸钠反应生成二氧化碳,酚羟基能和碳酸钠反应生成碳酸氢钠,2mol羧基和碳酸钠反应生成1mol二氧化碳,所以1mol该物质与足量碳酸钠反应最多消耗3mol碳酸钠,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系式是解本题关键,涉及酚、烯烃和羧酸性质,注意酚羟基能和碳酸钠反应,但不能和碳酸氢钠反应.

练习册系列答案
相关题目
2.关于下列各装置图的叙述中,不正确的是( )
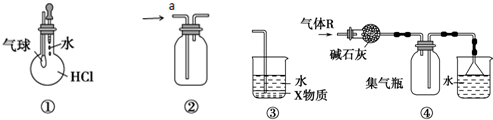

| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②a口进气可用于收集CO2、Cl2或NO等 | |
| C. | 装置③中X为四氯化碳,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
3.根据表中信息,判断以下叙述正确的是部分短周期元素的原子半径及主要化合价( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的剧烈程度为L<Q | |
| C. | R最高价氧化物对应水化物是强酸 | |
| D. | L2+与R2-的核外电子数相等 |
20.化学已渗透到人类生活的各个方面.下列说法不正确的是( )
| A. | 纤维素在人体内不能被消化吸收,可帮助消化 | |
| B. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 | |
| C. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| D. | 禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
7.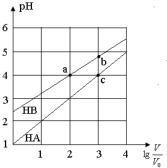 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c(B-)}{c(A-)}$减小 |
17.为检验溶液中是否含有Cl-,常采用向溶液中先加HNO3,再加AgNO3溶液的实验方案,若有白色沉淀生成,则证明有Cl-.对此结论,有人提出了质疑,设计了如表探究性实验.
实验一:向Na2SO4溶液中滴加AgNO3溶液
(1)实验一中产生沉淀的离子方程式为2Ag++SO42-═Ag2SO4↓.
(2)学生设计了如表表格,对实验一内容进行理论计算,请帮他完成表格.(表中不要留空格).
25℃时Ksp(Ag2SO4)=1.2×10-5,分析上面数据,若向l mL某溶液中加入3滴0.1mol•L-1 AgNO3溶液,判断下列说法正确的是AD(填字母序号).
A.混合液中c(SO42-)=0.1 mol•L-1 时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1 mol•L-1 时不会产生Ag2SO4沉淀
C.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol•L-1 AgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)某同学在实验一的基础上继续设计了以下实验.
实验二:
已知:H2SO4=H++HSO4-、HSO4-═H++SO42-;对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设一.
假设一:H+对Ag2SO4起溶解作用.
假设二:NO3-对Ag2SO4溶解起作用.
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立.请补齐实验方案(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体).
①取少量CaSO4固体于试管中,加入一定量浓HNO3,充分振荡.若沉淀溶解,说明假设一成立.
②取少量Ag2SO4固体于试管中,加入一定量NaNO3饱和溶液,充分振荡.若沉淀溶解,说明假设二成立说明假设二成立.
(5)通过(4)的实验发现假设一成立,请用平衡理论解释Ag2SO4溶解的原因Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),H+与SO42-结合生成HSO4-,SO42-浓度降低,平衡正向移动,Ag2SO4不断溶解.
结论:该同学组通过实验发现,考虑到Ag+对Cl-检验的灵敏度较高,通常情况下,实验室配制的用来检验Cl-的AgNO3浓度一般较小,所以SO42-对Cl-检验的干扰是完全可以排除的.
实验一:向Na2SO4溶液中滴加AgNO3溶液
| 编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积 | 浓度/(mol•L-1) | ||
| ① | 1 | 1 | 3滴 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3滴 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3滴 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3滴 | 0.01 | 无明显变化 |
(2)学生设计了如表表格,对实验一内容进行理论计算,请帮他完成表格.(表中不要留空格).
| 编号 | AgNO3浓度/(mol•L-) | 稀释后Ag+浓度/(mol•L-1) | 混合溶液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.01 | 0.12 |
| ④ | 0.01 | 0.001 |
A.混合液中c(SO42-)=0.1 mol•L-1 时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1 mol•L-1 时不会产生Ag2SO4沉淀
C.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol•L-1 AgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)某同学在实验一的基础上继续设计了以下实验.
实验二:
| 编号 | AgNO3浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
假设一:H+对Ag2SO4起溶解作用.
假设二:NO3-对Ag2SO4溶解起作用.
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立.请补齐实验方案(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体).
①取少量CaSO4固体于试管中,加入一定量浓HNO3,充分振荡.若沉淀溶解,说明假设一成立.
②取少量Ag2SO4固体于试管中,加入一定量NaNO3饱和溶液,充分振荡.若沉淀溶解,说明假设二成立说明假设二成立.
(5)通过(4)的实验发现假设一成立,请用平衡理论解释Ag2SO4溶解的原因Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),H+与SO42-结合生成HSO4-,SO42-浓度降低,平衡正向移动,Ag2SO4不断溶解.
结论:该同学组通过实验发现,考虑到Ag+对Cl-检验的灵敏度较高,通常情况下,实验室配制的用来检验Cl-的AgNO3浓度一般较小,所以SO42-对Cl-检验的干扰是完全可以排除的.
4.下列说法中错误的是( )
| A. | 化学视角是现代人所必须具备的科学素养中的重要组成部分 | |
| B. | 元素周期律的发现过程体现了物质分类思想和方法的运用 | |
| C. | 能源是现代文明的原动力,能源的开发和利用离不开化学 | |
| D. | 自然界一切物质都是由离子构成的 |
1.下列各组离子在溶液中可以大量共存的是( )
| A. | Mg2+、Fe3+、Cl-、OH- | B. | Ba2+、HCO3-、Cl-、Na+ | ||
| C. | Fe2+、SO42-、H+、NO3- | D. | K+、NH4+、SO42-、OH- |
2.下列各组物质的反应中,既是化合反应,又是氧化还原反应的是( )
| A. | NH3和O2反应 | B. | NH3和HNO3反应 | C. | NO和O2反应 | D. | NH3和水反应 |