题目内容
5.关于浓度均为0.1mol/L的四种溶液:①NH3•H2O、②HCl、③NH4Cl、④(NH4)2CO3,下列说法正确的是( )| A. | 由水电离出的c(H+):④>③>①>② | |
| B. | ①、②和③等体积混合后的溶液:pH=7 | |
| C. | c(NH4+):③>④>① | |
| D. | ①和②等体积混合后的溶液:c(NH4+)+c(NH3•H2O)=0.1mol/L |
分析 A.酸碱对水的电离起到抑制作用,易水解的盐促进水的电离;
B.①、②和③等体积混合后的溶液溶质为NH4Cl;
C.NH3•H2O是弱碱存在电离平衡,NH4Cl完全电离,(NH4)2CO3能电离出2个铵根离子;
D.①和②等体积混合后生成H4Cl,浓度变为原来的一半.
解答 解:A.酸碱对水的电离起到抑制作用,氢离子或氢氧根离子浓度越大,水的电离程度越小,盐酸中水电离出的氢离子最少,易水解的盐促进水的电离,而(NH4)2CO3是双水解水解程度较大,所以(NH4)2CO3中水电离出的氢离子浓度最大,所以由水电离出的c(H+):④>③>①>②,故A正确;
B.①、②和③等体积混合后的溶液溶质为NH4Cl,NH4Cl在溶液中水解显酸性,所以溶液的pH<7,故B错误;
C.NH3•H2O是弱碱存在电离平衡,溶液中铵根离子浓度较小,NH4Cl完全电离,(NH4)2CO3能电离出2个铵根离子,所以c(NH4+):④>③>①,故C错误;
D.①和②等体积混合后生成H4Cl,浓度变为原来的一半,则混合后的溶液:c(NH4+)+c(NH3•H2O)=0.05mol/L,故D错误.
故选A.
点评 本题考查了弱电解质的电离平衡应用、盐类水解应用、离子浓度大小的比较等,题目综合性较强,需要熟练掌握基础才能综合应用,侧重于考查学生的分析能力和对基础知识的综合应用能力.

练习册系列答案
相关题目
3.下列有关硫酸和硝酸的说法中,正确的是( )
| A. | 实验室中用铜片与稀HNO3反应制备NO2 | |
| B. | 常温下可以用铝制容器来盛装浓HNO3 | |
| C. | 实验室中用浓H2SO4干燥NH3 | |
| D. | 加热时,浓H2SO4不能将木炭氧化 |
10.利用碳酸钠晶体(Na2CO3•10H2O)来配制1.0mol•L-1 Na2CO3溶液500mL.假如其它操作都准确无误.下列情况会引起新配溶液的浓度偏高的是( )
| A. | 称取在空气中久置的碳酸钠晶体143.0g | |
| B. | 定容时,仰视观察刻度线 | |
| C. | 转移溶液时,用于溶解碳酸钠晶体的烧杯没有洗涤 | |
| D. | 定容后,将容量瓶震荡摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线 |
17.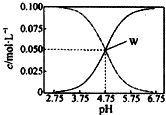 25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )
25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )
 25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )
25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )| A. | 25℃时,醋酸的电离常数K=1.0×10-4.75 | |
| B. | W点表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO- )>c(H+)>c(OH- ) | |
| D. | pH=4.0的溶液中:c( Na+)+c(H+)+c(CH3COOH)-c(OH- )=0.10mol/L |
 .
.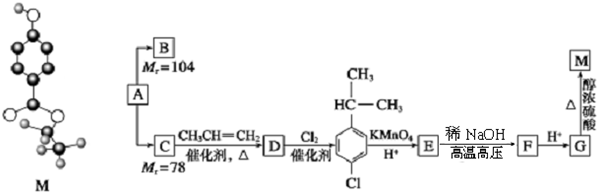

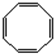 ,B与等物质的量Br2作用时可能有2种产物.
,B与等物质的量Br2作用时可能有2种产物.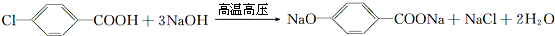 .
.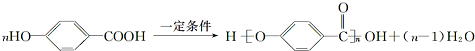 .
.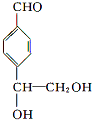 等.
等.