题目内容
6.I.甲乙两实验小组分工合作探究元素金属性、非金属性的强弱.请根据甲组的实验(如图1)回答问题:(1)实验1中发生的离子方程式为Mg2++2OH-=Mg(OH)2↓.
(2)实验2中的现象为刚滴入NaOH溶液时有白色沉淀生成,NaOH溶液过量后沉淀又溶解.
(3)根据实验1和实验2得出的结论是Mg元素的金属性比Al元素的金属性强.
II.已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,乙组设计了如图2实验,回答下列问题
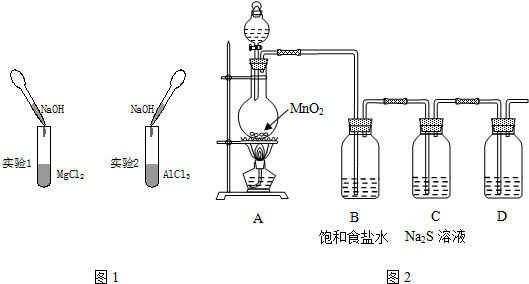
(4)装置A的分液漏斗中盛装的试剂是浓盐酸.
(5)装置B的作用吸收HCl.
(6)装置C中盛放的试剂是Na2S溶液,请写出相关反应方程式Cl2+Na2S=2NaCl+S↓.
(7)为防止污染空气,装置D中盛放的试剂可能是氢氧化钠溶液.
分析 I(1)氯化镁与氢氧化钠反应生成氢氧化镁沉淀与氯化钠;
(2)氢氧化钠与氯化铝反应生成氢氧化铝沉淀,氢氧化钠过量时氢氧化铝又反应生成偏铝酸钠;
(3)氢氧化镁不表现酸性,而氢氧化铝表现酸性;
II.A中制备氯气,B装置除去为HCl,C中氯气与硫化钠反应,验证元素非金属性强弱,D装置吸收氯气,防止污染空气,可以用氢氧化钠溶液吸收.
(4)实验室利用浓盐酸与二氧化锰在加热条件下制备氯气;
(5)饱和食盐水吸收HCl;
(6)氯气与硫化钠反应生成硫与硫化钠;
(7)氢氧化钠溶液可以与氯气反应.
解答 解:I(1)氯化镁与氢氧化钠反应生成氢氧化镁沉淀与氯化钠,反应离子方程式为:Mg2++2OH-=Mg(OH)2↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;
(2)氢氧化钠与氯化铝反应生成氢氧化铝沉淀,氢氧化钠过量时氢氧化铝又反应生成偏铝酸钠,现象为:刚滴入NaOH溶液时有白色沉淀生成,NaOH溶液过量后沉淀又溶解,
故答案为:刚滴入NaOH溶液时有白色沉淀生成,NaOH溶液过量后沉淀又溶解;
(3)氢氧化镁不表现酸性,而氢氧化铝表现酸性,说明Mg元素的金属性比Al元素的金属性强,
故答案为:Mg元素的金属性比Al元素的金属性强;
II.A中制备氯气,B装置除去为HCl,C中氯气与硫化钠反应,验证元素非金属性强弱,D装置吸收氯气,分子污染空气,可以用氢氧化钠溶液吸收.
(4)实验室利用浓盐酸与二氧化锰在加热条件下制备氯气,分液漏斗中盛放浓盐酸,
故答案为:浓盐酸;
(5)用饱和食盐水吸收HCl,可以降低氯气溶解度,
故答案为:吸收HCl;
(6)氯气与硫化钠反应生成硫与硫化钠,反应方程式为:Cl2+Na2S=2NaCl+S↓,
故答案为:Cl2+Na2S=2NaCl+S↓;
(7)用氢氧化钠溶液吸收氯气,防止污染空气,
故答案为:氢氧化钠溶液.
点评 本题考查元素性质探究实验,理解掌握金属性、非金属性强弱比较实验事实,注意实验中渗透环保意识,难度中等.

| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 将淀粉在酸性条件下水解后直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 除去苯中的苯酚的方法是:加溴水,振荡,过滤除去沉淀 | |
| D. | 除去混入CH3CH2OH中的蚁酸HCOOH:加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 |
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物CaCl2中,两个氯离子之间也存在离子键 | |
| C. | 分子中只有共价键的化合物一定是共价化合物 | |
| D. | 不同元素组成的多原子分子中的化学键一定为极性键 |
| A. | 二氧化硅和二氧化碳在物理性质上有很大的差别 | |
| B. | 二氧化硅分子由一个硅原子和两个氧原子构成 | |
| C. | 工业上用二氧化硅制粗硅 | |
| D. | 二氧化硅既能与氢氟酸反应,又能与烧碱反应,但它不是两性氧化物 |
| A. | 由水电离出的c(H+):④>③>①>② | |
| B. | ①、②和③等体积混合后的溶液:pH=7 | |
| C. | c(NH4+):③>④>① | |
| D. | ①和②等体积混合后的溶液:c(NH4+)+c(NH3•H2O)=0.1mol/L |
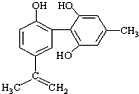 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )| A. | 1mol该物质分别与浓溴水和H2反应时最多消耗和分别为4mol和7mol | |
| B. | 滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质与苯酚属于同系物,遇溶液呈紫色 | |
| D. | 该分子中的所有碳原子不可能共平面 |
 .
.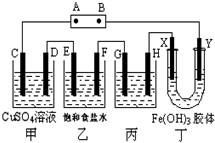 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: