题目内容
17. 25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )
25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )| A. | 25℃时,醋酸的电离常数K=1.0×10-4.75 | |
| B. | W点表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO- )>c(H+)>c(OH- ) | |
| D. | pH=4.0的溶液中:c( Na+)+c(H+)+c(CH3COOH)-c(OH- )=0.10mol/L |
分析 根据图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点时c(CH3COOH)=c(CH3COO-),
A.根据电离平衡常数公式解答;
B.根据W点溶液中电荷守恒判断;
C.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH );
D.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1分析.
解答 解:A.W点c(CH3COOH)=c(CH3COO-),pH=4.75,则c(H+)=10-4.75mol•L-1,平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=10-4.75mol•L-1,故A正确;
B.溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),W点时,溶液显酸性,则c(H+)>c(OH- ),所以W点表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+),故B正确;
C.随着溶液中pH增大,c(CH3COO-)增大,pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH ),所以溶液中:c(CH3COO-)>c(CH3COOH )>c(H+)>c(OH- ),故C错误;
D.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(CH3COOH)=0.1mol/L,故D正确;
故选C.
点评 本题考查离子浓度大小比较,溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,再结合守恒思想分析解答,题目难度中等.

练习册系列答案
相关题目
18.下列关于二氧化硅的说法中,错误的是( )
| A. | 二氧化硅和二氧化碳在物理性质上有很大的差别 | |
| B. | 二氧化硅分子由一个硅原子和两个氧原子构成 | |
| C. | 工业上用二氧化硅制粗硅 | |
| D. | 二氧化硅既能与氢氟酸反应,又能与烧碱反应,但它不是两性氧化物 |
5.关于浓度均为0.1mol/L的四种溶液:①NH3•H2O、②HCl、③NH4Cl、④(NH4)2CO3,下列说法正确的是( )
| A. | 由水电离出的c(H+):④>③>①>② | |
| B. | ①、②和③等体积混合后的溶液:pH=7 | |
| C. | c(NH4+):③>④>① | |
| D. | ①和②等体积混合后的溶液:c(NH4+)+c(NH3•H2O)=0.1mol/L |
2. 25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
 25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:a<b<c | |
| B. | 溶液中c(H+):b>a>c | |
| C. | a、b、c三点的溶液都有c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 从b点到c点,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值减小 |
9.已知AB2+D2═B2+AD2,2AB2+3D2═2AD3+2B2,AC2+B2═AB2+C2(反应中涉及的化合物均属于离子化合物,阴离子均显-1价),下列有关说法中不正确的是( )
| A. | 氧化性强弱:D2>B2 | B. | D2能氧化C- | ||
| C. | 还原性强弱:A2+>B- | D. | 第二个反应中A3+是氧化产物 |
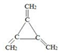
6.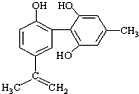 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )| A. | 1mol该物质分别与浓溴水和H2反应时最多消耗和分别为4mol和7mol | |
| B. | 滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质与苯酚属于同系物,遇溶液呈紫色 | |
| D. | 该分子中的所有碳原子不可能共平面 |
7.工业上用白云石制备高纯氧化镁的工艺流程如下:
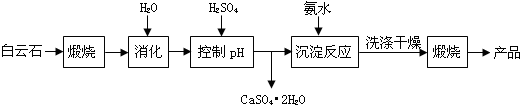
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%.
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石粉碎.若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要BC(填序号).
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示.则由图示可得到的结论及原因是:
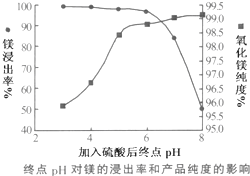
①pH过高会导致镁浸出率降低下降,其原因是Mg(OH)2或MgO未完全溶解
②pH过低会引起产品纯度下降,其原因可能是AC(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
根据上表数据,简要说明析出CaSO4.2H2O的操作步骤是升温结晶、趁热过滤.
(4)写出沉淀反应中的离子方程式:Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+.
(5)该生产流程中还可得到的一种副产品是(NH4)2SO4.
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色(25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12).

已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%.
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石粉碎.若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要BC(填序号).
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示.则由图示可得到的结论及原因是:

①pH过高会导致镁浸出率降低下降,其原因是Mg(OH)2或MgO未完全溶解
②pH过低会引起产品纯度下降,其原因可能是AC(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(4)写出沉淀反应中的离子方程式:Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+.
(5)该生产流程中还可得到的一种副产品是(NH4)2SO4.
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色(25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12).
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 .
.