题目内容
15.已知某混和气体的体积百分组成中有80.0%的CH4、15.0%C2H2、5.0%的C2H4,请计算0.5摩尔该混和气体的质量和在标准状态下的密度(克/升).分析 根据根据混和气体的体积百分组成即为物质的量的百分组成来计算质量,再根据ρ=$\frac{m}{V}$计算混合气体的密度.
解答 解:0.5摩尔该混和气体的质量=0.500mol×(16g/mol×80.0%+26g/mol×15.0%+28g/mol×5.0%)=9.05g;
混合气体的密度=$\frac{9.05g}{22.4L/mol×0.5mol}$=0.808(g/l);
故答案为:9.05g;0.808(g/l).
点评 本题主要考查学生对体积百分含量等于物质的量百分含量的理解,要求学生具备分析并进行计算的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
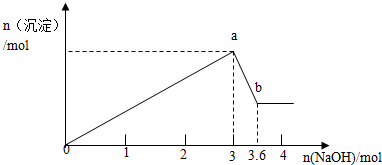
5.关于浓度均为0.1mol/L的四种溶液:①NH3•H2O、②HCl、③NH4Cl、④(NH4)2CO3,下列说法正确的是( )
| A. | 由水电离出的c(H+):④>③>①>② | |
| B. | ①、②和③等体积混合后的溶液:pH=7 | |
| C. | c(NH4+):③>④>① | |
| D. | ①和②等体积混合后的溶液:c(NH4+)+c(NH3•H2O)=0.1mol/L |
6.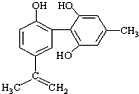 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )| A. | 1mol该物质分别与浓溴水和H2反应时最多消耗和分别为4mol和7mol | |
| B. | 滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质与苯酚属于同系物,遇溶液呈紫色 | |
| D. | 该分子中的所有碳原子不可能共平面 |
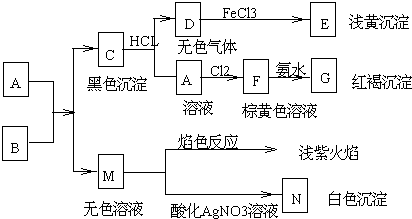
20.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 1mol铁与足量的盐酸反应转移电子数为2 NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
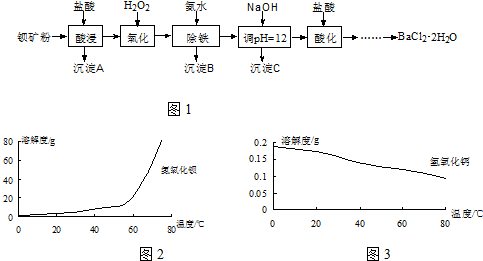
7.工业上用白云石制备高纯氧化镁的工艺流程如下:
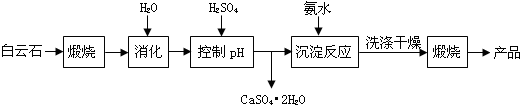
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%.
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石粉碎.若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要BC(填序号).
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示.则由图示可得到的结论及原因是:
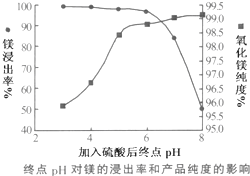
①pH过高会导致镁浸出率降低下降,其原因是Mg(OH)2或MgO未完全溶解
②pH过低会引起产品纯度下降,其原因可能是AC(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
根据上表数据,简要说明析出CaSO4.2H2O的操作步骤是升温结晶、趁热过滤.
(4)写出沉淀反应中的离子方程式:Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+.
(5)该生产流程中还可得到的一种副产品是(NH4)2SO4.
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色(25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12).

已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%.
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石粉碎.若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要BC(填序号).
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示.则由图示可得到的结论及原因是:

①pH过高会导致镁浸出率降低下降,其原因是Mg(OH)2或MgO未完全溶解
②pH过低会引起产品纯度下降,其原因可能是AC(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(4)写出沉淀反应中的离子方程式:Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+.
(5)该生产流程中还可得到的一种副产品是(NH4)2SO4.
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色(25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12).
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
4.为了除去铝表面的铜镀层,可选用的试剂是( )
| A. | 烧碱溶液 | B. | 盐酸 | C. | 稀硝酸 | D. | 浓硝酸 |