题目内容
4.书写下列反应的化学方程式.(1)乙醇与氧化铜加热CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O.
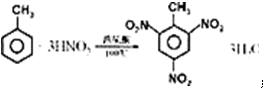
(2)制备TNT的反应
 .
.
分析 (1)乙醇与氧化铜加热可生成乙醛、铜和水;
(2)甲苯和浓硝酸在浓硫酸作用下加热生成TNT.
解答 解:(1)乙醇与氧化铜加热可生成乙醛、铜和水,方程式为CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O,
故答案为:CuO+C2H5OH$\stackrel{△}{→}$Cu+CH3CHO+H2O;
(2)甲苯和浓硝酸在浓硫酸作用下加热生成TNT,方程式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力和双基的掌握,注意把握有机物官能团的性质以及化学方程式的书写.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
15.对稳定人体血液的pH起重要作用的离子是( )
| A. | Na+ | B. | HCO3- | C. | Fe2+ | D. | Cl- |
16.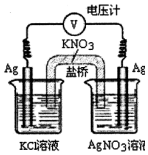 一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
 一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 右池中的银电极作正极 | B. | 总反应为Ag++Cl-═AgCl | ||
| C. | 正极反应为Ag-e-═Ag+ | D. | 盐桥中的NO3-向右池方向移动 |
12.把23g钠投入到m1 g足量的水中得到a g溶液,把24g镁投入到m2 g足量的盐酸中得到b g溶液,若m1=m2,则a,b的关系是( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
13.下列关于电解法精炼粗铜的叙述中不正确的是( )
| A. | 精铜板作阴极,纯铜片作阳极,CuSO4溶液作电解液 | |
| B. | 电解时,阴极发生氧化反应,则阴极发生的反应为:Cu2++2e-═Cu | |
| C. | 粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 | |
| D. | 电解铜的纯度可达99.95%~99.98% |
14.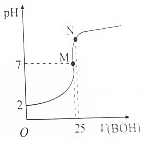 25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
 25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )| A. | BA溶液呈碱性 | |
| B. | 酸HA的电离常数约为0.0011 | |
| C. | M点时,c(B+)=c(A-)>c(H+)=c(OH-) | |
| D. | N点时加入10mL0.1000mol•L-1HA溶液,将促进A-的水解 |