题目内容
16.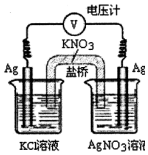 一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 右池中的银电极作正极 | B. | 总反应为Ag++Cl-═AgCl | ||
| C. | 正极反应为Ag-e-═Ag+ | D. | 盐桥中的NO3-向右池方向移动 |
分析 左池中银失电子发生氧化反应为负极,生成的银离子与氯离子结合成氯化银沉淀,右池银离子在电极银上得电子生成单质银,所以两个电极上银的质量增加,由此分析解答.
解答 解:A、左池银是负极,右池中的银电极作正极,故A正确;
B、总的电极反应式为:Ag++Cl-═AgCl↓,故B错误;
C、正极发生还原反应,而不是氧化反应,故C错误;
D、阴离子向负极移动,所以盐桥中的NO3-向左池方向移动,故D错误;
故选A.
点评 本题考查原电池知识,侧重于原电池的设计,注意把握电解方程式的书写以及原电池的工作原理,难度不大.

练习册系列答案
相关题目
6.《本草图经》中关于绿矾的分解有如下描述:“绿矾形似朴消(Na2SO4•10H2O)而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁者是真也.”对此段话的说明中肯定错误的是( )
| A. | 绿矾的化学式为FeSO4•7H2O | |
| B. | 绿矾分解过程中没有发生电子的转移 | |
| C. | “色赤”物质可能是Fe2O3 | |
| D. | 流出的液体中可能含有硫酸 |
7.Fe为26号元素,属于第四周期,最外层有2个电子.Fe3+最外层的电子数则为( )
| A. | 8 | B. | 13 | C. | 14 | D. | 18 |
4.化学在生产和生活中有着重要的作用,下列有关说法不正确的是( )
| A. | 小苏打可用作糕点的膨化剂 | |
| B. | “地沟油“经过加工处理可用来制肥皂 | |
| C. | 多地花重金购买“雾霾消除车“,从根本上缓解了雾霾问题 | |
| D. | 装饰材料释放的苯、甲苯、甲醛等易挥发性物质会导致室内空气污染 |
11.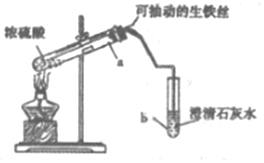 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
(1)该实验的操作依次是CAB (填序号).
A.加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯
B.将生铁丝上提离开液面
C.连接好装置,检验气密性,加人试剂
(2)b中的澄清石灰水变浑浊,甲同学认为产生的肯定是SO2气体,你是否同意不同意(填“同意”或“不同意)理由是.
(3)乙同学认为该反应过程中产生SO2、CO2、H2三种气体,请用如图所列各装置设计一个实验,来验证所产生的气体.(图中加热装置、夹持仪器省略,除装置⑤外,其他装置试剂均为足量)
①装置的连接顺序(按产物气流从左至右的方向→E→A→C→D→B(填装置的编号)
②证明生成的气体中存在SO2的现象是装置①中溶液紫红色变浅说明生成SO2,相应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量之比为1:4
(5)已知常温下H2SO3的电离平衡常数为:Ka1=10×10-1.9 Ka2=10-7.2计算0.1mol•L-1NaSO3溶液的pH
值10.1(忽略SO32-的二级水解)
 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.(1)该实验的操作依次是CAB (填序号).
A.加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯
B.将生铁丝上提离开液面
C.连接好装置,检验气密性,加人试剂
(2)b中的澄清石灰水变浑浊,甲同学认为产生的肯定是SO2气体,你是否同意不同意(填“同意”或“不同意)理由是.
(3)乙同学认为该反应过程中产生SO2、CO2、H2三种气体,请用如图所列各装置设计一个实验,来验证所产生的气体.(图中加热装置、夹持仪器省略,除装置⑤外,其他装置试剂均为足量)
| A | B | C | D | E |
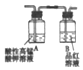 |  |  |  | 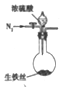 |
②证明生成的气体中存在SO2的现象是装置①中溶液紫红色变浅说明生成SO2,相应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量之比为1:4
(5)已知常温下H2SO3的电离平衡常数为:Ka1=10×10-1.9 Ka2=10-7.2计算0.1mol•L-1NaSO3溶液的pH
值10.1(忽略SO32-的二级水解)
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 60g丙醇含有的共价键数目为10NA | |
| B. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子数为0.3NA | |
| C. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| D. | 80ml10mol/L盐酸与足量MnO2加热反应,产生Cl2的分子数为0.2NA |
5.钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.
Ⅰ(1)LiCoO2中钴元素的化合价为+3.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O可用盐酸代替H2SO4和H2O2的混合液,但缺点是生成的氯气造成污染,且盐酸易挥发,浪费很大.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:
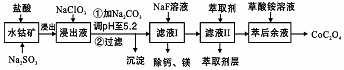
已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(3)浸出过程中加入NaClO3的目的是将Fe2+氧化为Fe3+,利于从混合液中除去.
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
Ⅰ(1)LiCoO2中钴元素的化合价为+3.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O可用盐酸代替H2SO4和H2O2的混合液,但缺点是生成的氯气造成污染,且盐酸易挥发,浪费很大.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:

已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
 .
.