题目内容
19.1892年德贝莱纳首次提出用MnO2催化KClO3热分解的反应制备O2.当时就知气态产物有异常的气味,后来证明其中含有少量Cl2、O3及极微量的ClO2.测定气态产物中Cl2、O3含量的一种方法是:收集1.00L气体(标准状况),使之通过KI溶液,通过溶液后的气体经干燥其体积变为0.98L,其中的O3被还原为O2,溶液中的KI被氧化为I2.I2与Na2S2O3反应的方程式为I2+2Na2S2O3═2NaI+Na2S4O6.反应过程中耗掉0.026 7L 0.100mol•L-1的Na2S2O3.O3与KI溶液反应的方程式为:O3+2KI+H2O═2KOH+I2+O2.求:气态反应产物中Cl2与O3的体积分数各是多少?
分析 当O2、Cl2、O3通入KI溶液时,发生下列反应:①Cl2+2KI═2KCl+I2,②O3+2KI+H2O═2KOH+I2+O2,由②式知该反应前后气体体积没变化,故引起体积变化的是①式的Cl2参与了反应,故Cl2的体积为1L-0.98L=0.02L,所以φ(Cl2)=$\frac{0.02L}{1L}$×100%=2%,
设O3的物质的量为xmol,则②式生成I2为xmol,①式生成I2为$\frac{0.02L}{22.4L/mol}$,由I2-2Na2S2O3关系,则有关系式:xmol+$\frac{0.02L}{22.4L/mol}$=$\frac{0.1mol/L×0.0267L}{2}$,解得x=4.42×10-4 mol,故O3的体积分数为$\frac{4.42×1{0}^{-4}mol×22.4L/mol}{1L}$×100%=1%,据此进行分析.
解答 解:当O2、Cl2、O3通入KI溶液时,发生下列反应:①Cl2+2KI═2KCl+I2,②O3+2KI+H2O═2KOH+I2+O2,由②式知该反应前后气体体积没变化,故引起体积变化的是①式的Cl2参与了反应,故Cl2的体积为1L-0.98L=0.02L,所以φ(Cl2)=$\frac{0.02L}{1L}$×100%=2%,
设O3的物质的量为xmol,则②式生成I2为xmol,①式生成I2为$\frac{0.02L}{22.4L/mol}$,由I2-2Na2S2O3关系,则有关系式:xmol+$\frac{0.02L}{22.4L/mol}$=$\frac{0.1mol/L×0.0267L}{2}$,解得x=4.42×10-4 mol,故O3的体积分数为$\frac{4.42×1{0}^{-4}mol×22.4L/mol}{1L}$×100%=1%.
答:气态反应产物中Cl2与O3的体积分数各是2%、1%.
点评 正确书写方程式是本题解题的关键,注意利用方程式确定物质之间的关系,本题题目难度中中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案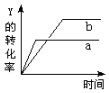 反应 2X(g)+3Y(g)?Z(g)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间的关系如图所示.若使曲线a变为曲线b,可采取( )
反应 2X(g)+3Y(g)?Z(g)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间的关系如图所示.若使曲线a变为曲线b,可采取( )| A. | 降低温度 | B. | 减小压强 | C. | 加入催化剂 | D. | 增大Y的浓度 |
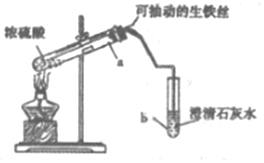 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.(1)该实验的操作依次是CAB (填序号).
A.加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯
B.将生铁丝上提离开液面
C.连接好装置,检验气密性,加人试剂
(2)b中的澄清石灰水变浑浊,甲同学认为产生的肯定是SO2气体,你是否同意不同意(填“同意”或“不同意)理由是.
(3)乙同学认为该反应过程中产生SO2、CO2、H2三种气体,请用如图所列各装置设计一个实验,来验证所产生的气体.(图中加热装置、夹持仪器省略,除装置⑤外,其他装置试剂均为足量)
| A | B | C | D | E |
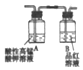 |  |  |  | 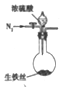 |
②证明生成的气体中存在SO2的现象是装置①中溶液紫红色变浅说明生成SO2,相应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量之比为1:4
(5)已知常温下H2SO3的电离平衡常数为:Ka1=10×10-1.9 Ka2=10-7.2计算0.1mol•L-1NaSO3溶液的pH
值10.1(忽略SO32-的二级水解)
| A. | 在空气质量日报中CO2含量属于空气污染指数 | |
| B. | 日常生活中和医院常用无水乙醇杀菌消毒 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 目前加碘食盐中主要添加的是KIO3 |
 过氧乙酸(
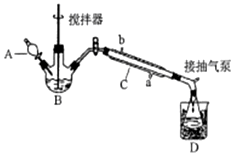
过氧乙酸( 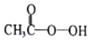 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水.
②不断搅拌并控制B中混合液的温度为20~30℃一段时间.
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品.
不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见表),请回答相关问题:
| 反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
| 0.5 | 1 | 3 | 5 | 7 | |
| 2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
| 1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
| 1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(2)反应物最佳比例($\frac{C{H}_{3}COOH}{{H}_{2}{O}_{2}}$)是1:1,反应所需时间约5(选填1、3、5、7)小时.
(3)为更好控制反应温度,应增加的措施是B用带温度计的水浴控温.
(4)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率.
可供选择的试剂和器材有:a.过氧乙酸溶液;b.1mol/L的FeCl3溶液;c.0.5mol/L的Fe2(SO4)3溶液;d.0.5mol/L的CuCl2溶液;e.1mol/L的CuSO4溶液;f.计时器;g.测量气体体积的针筒.
你选泽的试剂及器材是a、f、g(选填序号)实验方案是试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5mol/L的Fe2(SO4)3溶液(或c)和Imol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间).
(5)产品含量测定.
取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KmnO4溶液至恰好粉红色,以除去残余H2O2,加入10mL10%溶液和几滴淀粉溶液,摇匀,用0.1000mol/L的Na2S2O3标准液达到至终点(反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),共消耗13.20mL,Na2S2O3标准液.该样品中过氧乙酸的物质的量浓度是6.6mol/L.
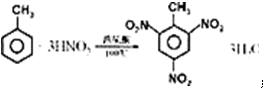 .
.