题目内容
13.下列关于电解法精炼粗铜的叙述中不正确的是( )| A. | 精铜板作阴极,纯铜片作阳极,CuSO4溶液作电解液 | |
| B. | 电解时,阴极发生氧化反应,则阴极发生的反应为:Cu2++2e-═Cu | |
| C. | 粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 | |
| D. | 电解铜的纯度可达99.95%~99.98% |
分析 电镀法精炼铜时,粗铜为阳极,精铜为阴极,阳极材料是粗铜,阳极上金属失电子变成离子进入溶液,Cu-2e-=Cu2+,比金属铜活泼的金属锌、铁、镍会先于金属铜失电子,比金属铜活泼性差的Pt、Ag等固体会沉积下来形成阳极泥,这样最终电解铜的纯度可达99.95%~99.98%,以此解答该题.
解答 解:A.电镀法精炼铜时,粗铜为阳极,纯铜为阴极,电解质为硫酸铜,故A错误;
B.电解时,阳极上只要是金属Cu失电子变成离子进入溶液,Cu-2e-=Cu2+,阳极发生氧化反应,故B错误;
C.粗铜中所含Pt、Au、Ag等金属杂质,电解后以单质形式沉积槽底,形成阳极泥,金属镍、铁都比铜活泼,先于金属铜失电子,故C错误;
D.阴极只有铜离子得到电子,电解铜的纯度可达99.95%~99.95%,故D正确.
故选D.
点评 本题考查电解原理及应用,为高频考点,把握粗铜精炼的原理、电极反应为解答的关键,侧重分析与应用能力的考查,注意阳极泥的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.化学在生产和生活中有着重要的作用,下列有关说法不正确的是( )
| A. | 小苏打可用作糕点的膨化剂 | |
| B. | “地沟油“经过加工处理可用来制肥皂 | |
| C. | 多地花重金购买“雾霾消除车“,从根本上缓解了雾霾问题 | |
| D. | 装饰材料释放的苯、甲苯、甲醛等易挥发性物质会导致室内空气污染 |
8.下列叙述正确的是( )
| A. | 在空气质量日报中CO2含量属于空气污染指数 | |
| B. | 日常生活中和医院常用无水乙醇杀菌消毒 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 目前加碘食盐中主要添加的是KIO3 |
5.钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.
Ⅰ(1)LiCoO2中钴元素的化合价为+3.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O可用盐酸代替H2SO4和H2O2的混合液,但缺点是生成的氯气造成污染,且盐酸易挥发,浪费很大.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:
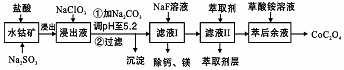
已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(3)浸出过程中加入NaClO3的目的是将Fe2+氧化为Fe3+,利于从混合液中除去.
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
Ⅰ(1)LiCoO2中钴元素的化合价为+3.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O可用盐酸代替H2SO4和H2O2的混合液,但缺点是生成的氯气造成污染,且盐酸易挥发,浪费很大.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:

已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
3.下列关于物质性质变化的比较中,正确的是( )
| A. | 酸性强弱HIO4<HBrO4<HClO4 | B. | 原子半径大小S>Na>O | ||
| C. | 碱性强弱KOH<NaOH<LiOH | D. | 金属性强弱Na<Mg<Al |
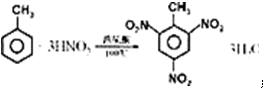 .
.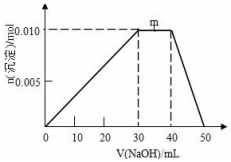 向盛有10mL1mol•L-1 NH4Al(SO4)2溶液的烧杯中滴加1mol•L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
向盛有10mL1mol•L-1 NH4Al(SO4)2溶液的烧杯中滴加1mol•L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下: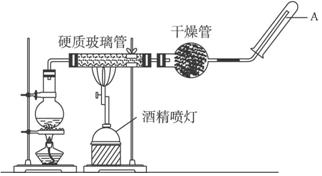 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.