题目内容
3.(1)25℃时,在0.10mol/L的氨水中逐滴加入同浓度的盐酸(不计两者的挥发性),回答下列问题:①当溶液pH=7时,溶液中c(NH4+)= c(Cl-)(用“<”、“>”、“=”填空,下同);
②当盐酸和氨水溶液恰好中和时,溶液中c(H+)>c(OH-);
(2)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路.某实验小组的同学对该厂生产的印刷电路后所得的废液进行了分析:取50mL废液,向其中加入足量的稀硝酸,生成0.02molNO;另取50mL废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g.请回答以下问题:
①该厂原来使用的FeCl3溶液中溶质的物质的量浓度为0.2mol/L(反应前后溶液的体积变化忽略不计);
②废液中各金属阳离子的物质的量浓度之比为C(Fe3+):C(Fe2+):C(Cu2+)=4:6:3;
③另取50mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围是0.12mol<n(Fe2+)≤0.15mol.
分析 (1)①根据溶液中的电荷守恒来回答;
②盐酸和氨水溶液恰好中和,指的是酸和碱的物质的量是相等的,此时得到的溶液为氯化铵溶液;
(2)①废液加入足量的AgNO3溶液,生成沉淀43.05g为AgCl质量,根据氯元素守恒计算溶液中n(FeCl3),根据c=$\frac{n}{V}$计算原废液中c(FeCl3);
②废液中加入硝酸发生反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,根据NO计算废液中n(Fe2+),再根据2Fe3++Cu=2Fe2++Cu2+,计算溶液中n(Cu2+)、参加反应Fe3+物质的量,进而计算废液中n(Fe3+),离子浓度之比等于物质的量之比;
③刚开始析出Cu时溶液中Fe2+的物质的量最小,Fe3+完全反应,发生反应:2Fe3++Fe=3Fe2+,Cu恰好完全析出时,溶液中Fe2+的物质的量最大,发生反应Cu2++Fe=Fe2++Cu,由(2)中数据结合方程式计算.
解答 解:(1)①当溶液pH=7时,即显示中性,c(H+)=c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),则溶液中c(NH4+)=c(Cl-),
故答案为:=;
②当盐酸和氨水溶液恰好中和时,指的是酸和碱的物质的量按照1:1反应,此时得到的溶液为氯化铵溶液,铵根离子水解导致溶液显示酸性,即c(H+)>c(OH-),故答案为:>;
(2)①废液加入足量的AgNO3溶液,生成沉淀43.05g为AgCl质量,其物质的量=$\frac{43.05g}{143.5g/mol}$=0.3mol,根据氯元素守恒,原溶液中n(FeCl3)=$\frac{1}{3}$n(AgCl)=$\frac{1}{3}$×0.3mol=0.1mol,故原废液中c(FeCl3)=$\frac{0.1mol}{0.05L}$=2mol/L,
故答案为:2mol/L;
②由3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,可知废液中n(Fe2+)=3n(NO)=0.02mol×3=0.06mol,根据2Fe3++Cu=2Fe2++Cu2+,可知溶液n(Cu2+)=$\frac{1}{2}$n(Fe2+)=$\frac{1}{2}$×0.06mol=0.03mol、参加反应Fe3+物质的量=n(Fe2+)=0.06mol,故废液中n(Fe3+)=0.1mol-0.06mol=0.04mol,离子浓度之比等于物质的量之比,故c(Fe3+):c(Fe2+):c(Cu2+)=0.04mol:0.06mol:0.03mol=4:6:3,
故答案为:4:6:3;
③刚开始析出Cu时溶液中Fe2+的物质的量最小,Fe3+完全反应,则:
2Fe3++Fe=3Fe2+
0.04mol 0.06mol
故Fe2+的物质的量极小值为0.06mol+0.06mol=0.12mol,由于析出Cu,故Fe2+的物质的量最小大于0.12mol,
Cu恰好完全析出时,溶液中Fe2+的物质的量最大,则:
Cu2++Fe=Fe2++Cu
0.03mol 0.03mol
故溶液中Fe2+的物质的量最大为0.12mol+0.03mol=0.15mol,
故溶液中0.12mol<n(Fe2+)≤0.15mol,
故答案为:0.12mol<n(Fe2+)≤0.15mol.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较及混合物反应的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、盐的水解原理的含义及应用方法.


已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如表:
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),滤渣C的成分为Fe(OH)3(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取滤液C少量于试管中,滴加几滴KSCN溶液,若溶液变为血红色,证明滤液C中的Fe3+离子未除尽,反之已除尽.
(3)第③步反应中加入适量的氧化铜,将溶液的pH调到3.2-4.7之间;
(4)第④步需要在氯化氢气流中蒸干制取无水氯化铜,氯化氢的作用是HCl抑制CuCl2水解,也可用P2O5作脱水剂,使CuCl2•2H2O脱水制得无水氯化铜,该过程属于化学(填“物理”或“化学”)变化;
(5)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.1mol?L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均体积为46.00mL,则该无水氯化铜产品中CuCl2的质量分数约为0.89.
| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |


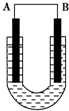 把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:
把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题: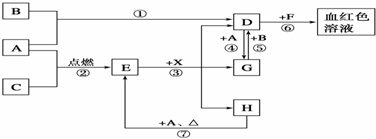
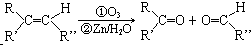

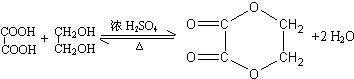 ;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、
;分子中有2个羧基、且能使Br2的CCl4溶液褪色的G的同分异构体有HOOC-CH=CH-COOH、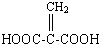 (写结构简式).
(写结构简式).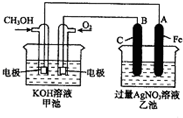 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O