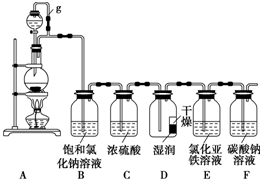
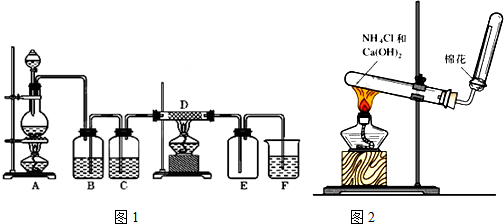
题目内容
16.下列说法正确的是( )| A. | 等体积等物质的量浓度的Na2CO3和Na2SO4溶液,Na2SO4溶液中的离子总数多于Na2CO3溶液 | |
| B. | 相同温度下,pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液:c(NaClO)>c(NaHCO3)>c(NaOH) | |
| C. | 常温下,CH3COONa与HCl溶液混合所得中性溶液:c(Na+)=c(Cl-)>c(H+)=c(OH一) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
分析 A、根据n=cV可知,等体积、等物质的量浓度Na2SO4和Na2CO3溶液中含有的Na2SO4和Na2CO3的物质的量相等,根据碳酸根离子水解导致溶液阴离子总数增多进行解答;
B、酸根对应的酸越弱,水解程度越大,相等pH的溶液浓度越小,酸性H2CO3>HClO,所以pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液,浓度大小为:c(NaHCO3)>c(NaClO)>c(NaOH);
C、CH3COONa与HCl混合溶液,根据电荷守恒c(Na+)+c(H+)=c(Cl-)+c(OH一)+c(CH3COO-),而溶液呈中性c(H+)=c(OH一),所以c(Na+)=c(Cl-)+c(CH3COO-);
D、根据混合溶液中的电荷守恒和物料守恒来分析.
解答 解:A、等体积等物质的量浓度的Na2CO3和Na2SO4溶液中,碳酸钠水解,CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,阴离子数增多,所以Na2SO4溶液中的离子总数小于Na2CO3溶液,故A错误;
B、酸根对应的酸越弱,水解程度越大,相等pH的溶液浓度越小,酸性H2CO3>HClO,所以pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液,浓度大小为:c(NaHCO3)>c(NaClO)>c(NaOH),故B错误;
C、CH3COONa与HCl混合溶液,根据电荷守恒c(Na+)+c(H+)=c(Cl-)+c(OH一)+c(CH3COO-),而溶液呈中性c(H+)=c(OH一),所以c(Na+)=c(Cl-)+c(CH3COO-),故C错误;
D、根据混合溶液中的物料守恒可有:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)]①,根据物料守恒可有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)②,将①②两式联立可得:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3),故D正确;
故选D.
点评 本题考查较为综合,涉及弱电解质的电离、盐类的水解以及离子浓度大小的比较,学生要注意物料和电荷守恒的应用,题目难度中等.

| A. | 粉末中一定有Na2O、Na202、NaHC03 | |
| B. | 粉末中一定不含有Na2C03和NaCl | |
| C. | 粉末中一定不含有Na20和NaCl | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaC1 |
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对该反应速率的影响; c.实验①和④探究催化剂对该反应速率的影响. |
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | 0.010 | |
| ④ | 298 | 0 | 0.010 |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |
 把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:
把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题: