题目内容
19.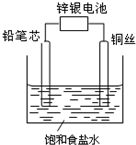 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:(1)该锌银电池工作时,阳离子向正极(填“正极”或“负极”)移动;
负极的电极反应式为Zn-2e-+2OH-=ZnO+H2O.
(2)废旧锌银电池的电极材料氧化银可回收利用得到银,其化学方程式为2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑.
(3)某实验小组设计家庭实验用锌银电池为电源电解饱和食盐水的装置如图,通电一段时间后没有出现预期现象,而是溶液中出现沉淀,则铅笔芯连接的是电池的负极(填“正极”或“负极”),电解总反应为Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑.
分析 (1)原电池内部阳离子向正极移动,锌在负极失电子生成氧化锌;
(2)氧化银受热分解生成Ag和氧气;
(3)Cu作阳极,Cu失电子生成铜离子,铅笔芯作阴极,阴极上氢离子得电子生成氢气和氢氧根离子,铜离子与氢氧根离子结合生成沉淀.
解答 解:(1)已知电池总反应为Zn+Ag2O═ZnO+2Ag,Zn失电子作负极,Ag作正极,原电池内部阳离子向正极移动;锌在负极失电子生成氧化锌,则负极的电极反应式为:Zn-2e-+2OH-=ZnO+H2O;
故答案为:正极;Zn-2e-+2OH-=ZnO+H2O;
(2)氧化银受热分解生成Ag和氧气,其化学方程式为2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑;
故答案为:2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑;
(3)Cu作阳极,Cu失电子生成铜离子,铅笔芯作阴极,阴极上氢离子得电子生成氢气和氢氧根离子,铜离子与氢氧根离子结合生成沉淀,电解方程式为Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑;
故答案为:负极;Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑.
点评 本题考查原电池与电解池工作原理、金属冶炼等,注意把握电极的判断方法和电极方程式的书写方法,题目难度中等,侧重于考查学生对基础知识的应用能力和分析能力.

练习册系列答案
相关题目
19.下列说法不正确的是( )
| A. | HNO3、NaOH、BaSO4均属于电解质 | |
| B. | SO2、NO2、CO2均能形成酸雨 | |
| C. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 | |
| D. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 |
10.短周期元素X的第一至第六电离能分别为:
I1=578KJ•mol-1 I2=1817KJ•mol一1 I3=2745KJ•mol一1
I4=11575KJ•mol一1I5=14830KJ•mol一1 I6=18376KJ•mol-1.
以下说法正确的是( )
I1=578KJ•mol-1 I2=1817KJ•mol一1 I3=2745KJ•mol一1
I4=11575KJ•mol一1I5=14830KJ•mol一1 I6=18376KJ•mol-1.
以下说法正确的是( )
| A. | X原子的最外层只有1个电子 | |
| B. | 元素X常见化合价为+3 | |
| C. | X原子核外有3个未成对电子 | |
| D. | 元素X最高价氧化物的水合物为强碱 |
7.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成.将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定).若将该粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量.下列判断正确的是( )
| A. | 粉末中一定有Na2O、Na202、NaHC03 | |
| B. | 粉末中一定不含有Na2C03和NaCl | |
| C. | 粉末中一定不含有Na20和NaCl | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaC1 |
4.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素.实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
①实验②中用KMnO4的浓度变化来表示的平均反应速率为1×10-4mol•L-1•min-1(忽略混合前后溶液的体积变化).
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对该反应速率的影响; c.实验①和④探究催化剂对该反应速率的影响. |
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | 0.010 | |
| ④ | 298 | 0 | 0.010 |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
8.用下列气体和溶液进行喷泉实验,最终液体不能充满烧瓶的是( )
| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |


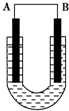 把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题:
把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.填空完成问题: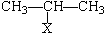 Ⅰ
Ⅰ CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点. 或
或
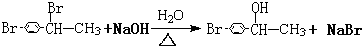 .
.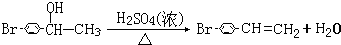 .
.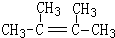 ,1molB完全燃烧时耗氧9mol
,1molB完全燃烧时耗氧9mol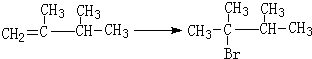
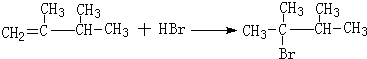
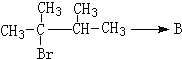
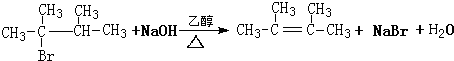 .
.