题目内容
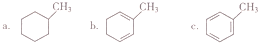
8.M(C3H6O2)、N(C4H10O)与W(C7H14O2)之间的转化关系为M+N$?_{△}^{H_{2}SO_{4}}$W+H20(已配平),下列说法不正确的是( )| A. | W有4种不同结构(不考虑立体异构) | |
| B. | M分子中的3个C原子一定在同一平面上 | |
| C. | M、N、W均可发生氧化反应、还原反应和取代反应 | |
| D. | 若N中的O原子为18O,则上述反应充分进行后,所得混合物中N和W均含有18O |
分析 由M、N、W得分子式以及转化关系可知M+N$?_{△}^{H_{2}SO_{4}}$W+H20为酯化反应,其中M为酸,应为CH3CH2COOH,N为丁醇,丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,则对应的醇有CH3CH2CH2CH2OH、CH3CH2CH(CH3)OH、CH3CH(CH3)CH2OH以及(CH3)3COH,结合酯化反应的特点解答该题.
解答 解:由M、N、W得分子式以及转化关系可知M+N$?_{△}^{H_{2}SO_{4}}$W+H20为酯化反应,其中M为酸,应为CH3CH2COOH,N为丁醇,
A.N为丁醇,丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,则对应的醇有CH3CH2CH2CH2OH、CH3CH2CH(CH3)OH、CH3CH(CH3)CH2OH以及(CH3)3COH,故A正确;
B.M为酸,应为CH3CH2COOH,由三点确定一个,平面可知3个C原子一定在同一平面上,故B正确;
C.丁醇为饱和醇,不能发生还原反应,故C错误;
D.酯化反应为可逆反应,且反应时醇中O-H键断裂,则若N中的O原子为18O,则上述反应充分进行后,所得混合物中N和W均含有18O,故D正确.
故选C.
点评 本题考查有机物的推断、同分异构体的书写等,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质以及同分异构体的判断,难度中等.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
19.下列说法不正确的是( )
| A. | HNO3、NaOH、BaSO4均属于电解质 | |
| B. | SO2、NO2、CO2均能形成酸雨 | |
| C. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 | |
| D. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 |
3.CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂.工业上用粗制的氧化铜粉末(含杂质FeO和SiO2)来制取无水CuCl2的工艺流程如图所示:

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如表:
(1)第②步反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
(2)滤渣A的成分有SiO2(填化学式),滤渣C的成分为Fe(OH)3(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取滤液C少量于试管中,滴加几滴KSCN溶液,若溶液变为血红色,证明滤液C中的Fe3+离子未除尽,反之已除尽.
(3)第③步反应中加入适量的氧化铜,将溶液的pH调到3.2-4.7之间;
(4)第④步需要在氯化氢气流中蒸干制取无水氯化铜,氯化氢的作用是HCl抑制CuCl2水解,也可用P2O5作脱水剂,使CuCl2•2H2O脱水制得无水氯化铜,该过程属于化学(填“物理”或“化学”)变化;
(5)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.1mol?L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均体积为46.00mL,则该无水氯化铜产品中CuCl2的质量分数约为0.89.

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如表:
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),滤渣C的成分为Fe(OH)3(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取滤液C少量于试管中,滴加几滴KSCN溶液,若溶液变为血红色,证明滤液C中的Fe3+离子未除尽,反之已除尽.
(3)第③步反应中加入适量的氧化铜,将溶液的pH调到3.2-4.7之间;
(4)第④步需要在氯化氢气流中蒸干制取无水氯化铜,氯化氢的作用是HCl抑制CuCl2水解,也可用P2O5作脱水剂,使CuCl2•2H2O脱水制得无水氯化铜,该过程属于化学(填“物理”或“化学”)变化;
(5)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.1mol?L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均体积为46.00mL,则该无水氯化铜产品中CuCl2的质量分数约为0.89.
3.下列说法不正确的是( )
| A. | 恒温恒容容器中发生反应C(s)+H2O(g)?CO(g)+H2(g),当混合气体密度不变时反应达到平衡 | |
| B. | 平衡向右移动时,反应物的转化率一定增大,平衡常数不一定增大 | |
| C. | 恒温时向BaSO4悬浊液中加入Na2SO4固体,Ba2+浓度减小,溶度积KsP (BaSO4)不变 | |
| D. | 向氨水中逐滴加入盐酸,溶液呈中性时离子浓度为:c(Cl-)═c(NH4+)>c(H+)=c(OH-) |
10.短周期元素X的第一至第六电离能分别为:
I1=578KJ•mol-1 I2=1817KJ•mol一1 I3=2745KJ•mol一1
I4=11575KJ•mol一1I5=14830KJ•mol一1 I6=18376KJ•mol-1.
以下说法正确的是( )
I1=578KJ•mol-1 I2=1817KJ•mol一1 I3=2745KJ•mol一1
I4=11575KJ•mol一1I5=14830KJ•mol一1 I6=18376KJ•mol-1.
以下说法正确的是( )
| A. | X原子的最外层只有1个电子 | |
| B. | 元素X常见化合价为+3 | |
| C. | X原子核外有3个未成对电子 | |
| D. | 元素X最高价氧化物的水合物为强碱 |
7.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成.将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定).若将该粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量.下列判断正确的是( )
| A. | 粉末中一定有Na2O、Na202、NaHC03 | |
| B. | 粉末中一定不含有Na2C03和NaCl | |
| C. | 粉末中一定不含有Na20和NaCl | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaC1 |
8.用下列气体和溶液进行喷泉实验,最终液体不能充满烧瓶的是( )
| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |