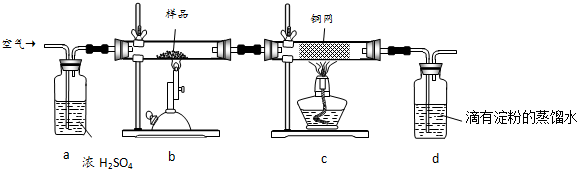
题目内容
17.制备过氧化氢的传统方法是在过氧化钡中加入稀硫酸.以重晶石(BaSO4)为原料制备过氧化氢的流程如图1: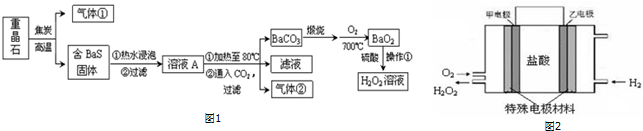
回答下列问题:
(1)图1中的气体①可能含有的物质是D.
①CO ②CO2 ③SO2
A.仅①③B.仅②③C.仅①②D.全部
(2)BaS不能存在于水中,BaS溶于水后,S元素主要以HS-的形式存在,用化学方程式表示其原因:2BaS+2H2O?Ba(OH)2+Ba(HS)2.
(3)已知:Ba(OH)2(aq)+CO2(g)═BaCO3(s)+H2O(l)△H=-162kJ•mol-1
2H2S(g)+Ba(OH)2(aq)═Ba(HS)2(aq)+2H2O(l)△H=-191kJ•mol-1
写出CO2 和Ba(HS)2反应的热化学反应方程式:Ba(HS)2(aq)+CO2(g)+H2O(l)=BaCO3(s)+2 H2S(g)△H=+29kJ•mol-1.需将溶液A加热的原因是上述反应为吸热反应,加热可使平衡向正反应方向移动,提高BaCO3产率.
(4)气体②可进一步加工成为上述制取H2O2流程中的一种原料,该原料是H2SO4.
(5)通入的CO2若含有O2会有BaSO4生成,所以通常增大溶液的pH以提高CO32-浓度,把BaSO4转化为BaCO3.若测得SO42-的浓度为1×10-4mol•L-1,则CO32-的浓度需大于2.5×10-3mol•L-1,才不致于生成BaSO4沉淀,已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9
(6)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H2和O2为原料制取过氧化氢的新工艺.原理如图2所示,请写出甲电极的电极反应式:2H++O2+2e-=H2O2.
分析 重晶石是BaSO4,由BaSO4和单质碳高温生成气体:BaSO4+4C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO↑.碳、一氧化碳高温燃烧生成气体CO2,BaS溶于H2O遇二氧化碳反应:BaS+H2O+CO2=BaCO3↓+H2S,硫化氢燃烧生成二氧化硫,含BaS的固体热水浸泡,2BaS+2H2O?Ba(OH)2+Ba(HS)2,过滤得到溶液A,通二氧化碳:Ba(HS)2+CO2+H2O=BaCO3↓+2H2S,Ba(OH)2+CO2=BaCO3↓+H2O,气体②为硫化氢,BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,2BaO+O2$\frac{\underline{\;300℃\;}}{\;}$2BaO2,BaO2+H2SO4=BaSO4↓+H2O2.
(1)生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等);
(2)在溶液中,硫离子水解导致溶液显示碱性;
(3)根据盖斯定律书写CO2 和Ba(HS)2反应的热化学反应方程式,根据影响化学平衡因素分析需将溶液A加热的原因;
(4)BaS不能存在于水中,BaS溶于水后,S元素主要以HS-的形式存在,故溶液A中存在大量Ba2+和HS-,和H2O、CO2反应生成CaCO3、H2S气体,即气体B的主要成分为H2S气体,H2S气体可用来制造H2SO4;
(5)根据溶解平衡常数计算;
(6)电极方程式的书写:先写出反应物、产物、电子,根据电荷守恒写出H+,原子守恒配平.
解答 解:(1)由BaSO4和单质碳高温生成气体:BaSO4+4C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO↑.碳、一氧化碳高温燃烧生成气体CO2,BaS溶于H2O遇二氧化碳反应:BaS+H2O+CO2=BaCO3↓+H2S,硫化氢燃烧生成二氧化硫,所以图1中的气体①可能①CO②CO2③SO2都有,
故答案为:D;
(2)在硫化钡中,硫离子水解而使得硫化钡显碱性,有碱Ba(OH)2生成,硫离子水解生成HS-,即2BaS+2H2O?Ba(OH)2+Ba(HS)2,
故答案为:2BaS+2H2O?Ba(OH)2+Ba(HS)2;
(3)Ba(OH)2(aq)+CO2(g)=BaCO3(s)+H2O(l)△H=-162kJ•mol-1①
2H2S(g)+Ba(OH)2(aq)=Ba(HS)2(aq)+2H2O(l)△H=-191kJ•mol-1②根据盖斯定律将①-②得:Ba(HS)2(aq)+CO2(g)+H2O(l)=BaCO3(s)+2 H2S(g)△H=+29kJ•mol-1,该反应为吸热反应,加热可使平衡向正反应方向移动,提高BaCO3产率,
故答案为:Ba(HS)2(aq)+CO2(g)+H2O(l)=BaCO3(s)+2 H2S(g)△H=+29kJ•mol-1;上述反应为吸热反应,加热可使平衡向正反应方向移动,提高BaCO3产率;
(4)BaS不能存在于水中,BaS溶于水后,S元素主要以HS-的形式存在,故溶液A中存在大量Ba2+和HS-,和H2O、CO2反应生成CaCO3、H2S气体,即气体B的主要成分为H2S气体,H2S气体和与氧气反应生成二氧化硫、二氧化硫和氧气反应生成三氧化硫,三氧化硫和水反应生成硫酸,所以硫化氢可用来制造H2SO4,
故答案为:H2SO4;
(5)有BaSO4沉淀的溶液中:Ksp(BaSO4)=cC(Ba2+)•C(SO42-)=1×10-10,若测得SO42-的浓度为1×10-4mol•L-1,则:cC(Ba2+)=$\frac{Ksp(BaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{1×1{0}^{-10}}{1×1{0}^{-4}}$=1×10-6mol•L-1,即该溶液中Ba2+的浓度为1×10-6mol•L-1,要生成BaCO3沉淀,需要满足cC(Ba2+)•C(CO32-)≥Ksp(BaCO3)=2.5×10-9
C(CO32-)≥$\frac{Ksp(BaC{O}_{3})}{c(B{a}^{2+})}$=$\frac{2.5×1{0}^{-9}}{1×1{0}^{-6}}$=2.5×10-3mol•L-1;
故答案为:2.5×10-3mol•L-1;
(6)据图2所示甲电极上消耗O2,生成H2O2,1molO2生成1molH2O2时失去2mol电子,电解质溶液为盐酸,酸性条件下,离子反应方程式为:2H++O2+2e-=H2O2;
故答案为:2H++O2+2e-=H2O2.
点评 本题以重晶石(BaSO4)为原料制备过氧化氢为载体,考查物质推断、热化学方程式的书写、水解化学方程式书写、沉淀转化的有关知识以及电极方程式的书写等,是对所学知识的综合运用与能力的考查,根据已有知识结合工艺流程推断物质及发生反应是解题关键,题目难度中等.

 全能练考卷系列答案
全能练考卷系列答案| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应为吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$ | |
| C. | 其他条件不变时,增大体系的压强,化学平衡常数减小 | |
| D. | 单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 |
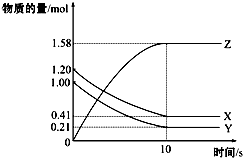 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79 mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 在前10s内用X、Y、Z表示的反应速率数值相等 |
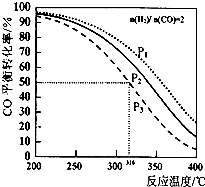 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )| A. | 该反应的△H>O | |
| B. | P1<P2<P3 | |
| C. | 若在P3和316℃时反应达到平衡,H2的转化率等于50% | |
| D. | 若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,则平衡时二甲醚的体积分数增大 |
| A. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| B. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 用BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |