题目内容
9.一密闭容器中,反应aA(气)?bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则(1)平衡向正反应 (选择“正反应”或“逆反应”)方向移动
(2)物质B的质量分数增加(填“增加”或“减少“)
(3)a<b(填“<”“>”“﹦”)
分析 将容器体积增加一倍,若平衡不移动,B的浓度为原来的50%,而当达到新的平衡时,B的浓度是原来的60%,可知体积增大、压强减小,平衡正向移动,以此来解答.
解答 解:将容器体积增加一倍,若平衡不移动,B的浓度为原来的50%,而当达到新的平衡时,B的浓度是原来的60%,可知体积增大、压强减小,平衡正向移动,
(1)由上述分析可知,平衡向正反应方向移动,故答案为:正反应;
(2)总质量不变,B的含量增大,则物质B的质量分数增加,故答案为:增加;
(3)减小压强平衡正向移动,可知化学计量数a<b,故答案为:<.
点评 本题考查化学平衡的移动,为高频考点,把握体积变化对平衡移动的影响为解答的关键,侧重分析与应用力的考查,注意体积与压强的转化,题目难度不大.

练习册系列答案
相关题目
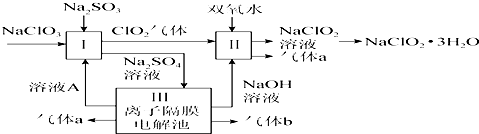
4.(1)氯碱工业是利用电解食盐水生产氯气、烧碱、氢气为基础的工业体系.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
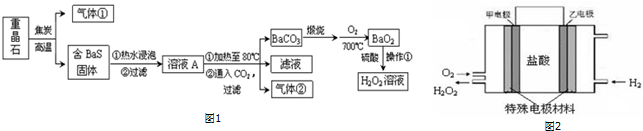
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
为了生产七水硫酸镁,设计了以下工艺流程:
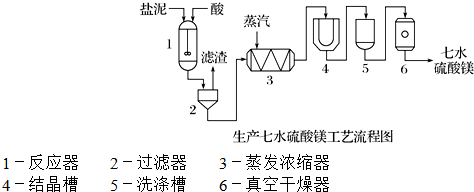
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动;.
装置2中滤渣的主要成分为CaSO4、BaSO4等其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
| 成 分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数/% | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动;.
装置2中滤渣的主要成分为CaSO4、BaSO4等其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
1.下列离子方程式书写不正确的是( )
| A. | 制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+ | |
| C. | 用NaHCO3 治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 氯化铁和氢氧化钾溶液混合:Fe3++3OH-═Fe(OH)3↓ |
18.某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如表:
(1)取实验2后的溶液,进行如图实验:
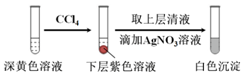
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:ClO3-+6I-+6H+═Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.
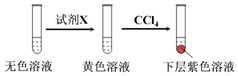
其中试剂X可以是c(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是2ClO3-+I2═Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
①对比实验4和5,可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关.
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
| 实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
 | 1 | 0.05 mL | 浅黄色 | 无色 |
| 2 | 0.20 mL | 深黄色 | 无色 | |
| 3 | 0.25 mL | 浅黄色 | 蓝色 | |
| 4 | 0.30 mL | 无色 | 蓝色 |

经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:ClO3-+6I-+6H+═Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.

其中试剂X可以是c(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是2ClO3-+I2═Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
| 编号 | 6.0 mol•L-1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25 mL | 浅黄色 | 无色 |
| 6 | 0.85 mL | 无色 | 蓝色 |
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
9.在2L密闭容器中进行反应:mX(g)+nY(g)?pZ(g)+qQ(g),式中m、n、p、q为物质系数.在0min~3min 内,各物质物质的量的变化如表所示:
已知2min内 v(Q)=0.075mol•L-1•min-1,且 v(z):v(Y)=1:2
(1)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(2)方程式中m=1
(3)用Z表示2min内的反应速率0.05mol•L-1•min-1.
(4)2min末Q的转化率为10%.
 | X | Y | Z | Q |
| 起始(mol) | 0.7 | 1 | ||
| 2min末(mol) | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末(mol) | 0.6 |
(1)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(2)方程式中m=1
(3)用Z表示2min内的反应速率0.05mol•L-1•min-1.
(4)2min末Q的转化率为10%.