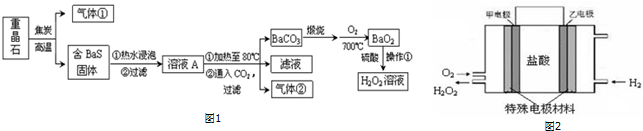
题目内容
7.取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液(溶液体积为200mL),再用过量稀硝酸处理沉淀.最后减少到4.66g,并有气体放出.(请写出计算过程)(1)产生的气体在标准状况下的体积为多少?
(2)过滤出沉淀后,计算所得滤液的物质的量浓度为多少?
分析 由Na2CO3+Ba(OH)2=BaCO3↓+2NaOH、Na2SO4+Ba(OH)2=BaSO4↓+2NaOH可知,14.51g为碳酸钡、硫酸钡的混合物,加稀硝酸,碳酸钡溶解,最后4.66g为硫酸钡,以此来解答.
解答 解:(1)由BaCO3~Na2CO3~CO2可知,产生的气体在标准状况下的体积为$\frac{14.51g-4.66g}{197g/mol}$×22.4L/mol=1.12L,
答:产生的气体在标准状况下的体积1.12L;
(2)n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,n(BaCO3)=0.05mol,结合Na2CO3+Ba(OH)2=BaCO3↓+2NaOH、Na2SO4+Ba(OH)2=BaSO4↓+2NaOH可知生成NaOH为0.02mol×2+0.05mol×2=0.14mol,则NaOH溶液的浓度为$\frac{0.14mol}{0.2L}$=0.7mol/L,
答:所得滤液的物质的量浓度为0.7mol/L.
点评 本题考查化学反应的计算,为高频考点,把握物质的性质、发生的反应、物质的量关系等为解答的关键,侧重分析与计算能力的考查,注意原子守恒的应用,题目难度不大.

练习册系列答案
相关题目
18.某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如表:
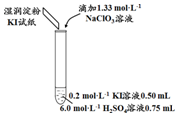
(1)取实验2后的溶液,进行如图实验:
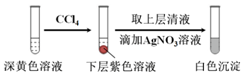
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:ClO3-+6I-+6H+═Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.
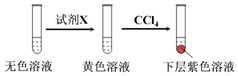
其中试剂X可以是c(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是2ClO3-+I2═Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
①对比实验4和5,可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关.
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
| 实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
 | 1 | 0.05 mL | 浅黄色 | 无色 |
| 2 | 0.20 mL | 深黄色 | 无色 | |
| 3 | 0.25 mL | 浅黄色 | 蓝色 | |
| 4 | 0.30 mL | 无色 | 蓝色 |

经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:ClO3-+6I-+6H+═Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.

其中试剂X可以是c(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是2ClO3-+I2═Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
| 编号 | 6.0 mol•L-1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25 mL | 浅黄色 | 无色 |
| 6 | 0.85 mL | 无色 | 蓝色 |
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
15.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
9.在2L密闭容器中进行反应:mX(g)+nY(g)?pZ(g)+qQ(g),式中m、n、p、q为物质系数.在0min~3min 内,各物质物质的量的变化如表所示:
已知2min内 v(Q)=0.075mol•L-1•min-1,且 v(z):v(Y)=1:2
(1)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(2)方程式中m=1
(3)用Z表示2min内的反应速率0.05mol•L-1•min-1.
(4)2min末Q的转化率为10%.
 | X | Y | Z | Q |
| 起始(mol) | 0.7 | 1 | ||
| 2min末(mol) | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末(mol) | 0.6 |
(1)试确定以下物质的相关量:起始时n(Y)=2.3mol,n(Q)=3mol.
(2)方程式中m=1
(3)用Z表示2min内的反应速率0.05mol•L-1•min-1.
(4)2min末Q的转化率为10%.