��Ŀ����
2����ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ��SiO2����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ�ijͬѧ���������ʵ�飺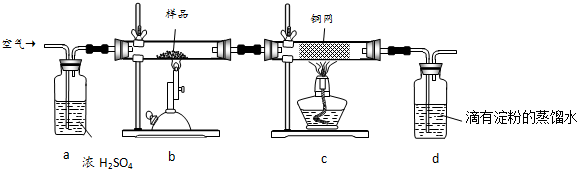
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.840g���ڿ��������½������գ�����Cu��Fe3O4��SO2���壬ʵ���ȡd����Һ��$\frac{1}{10}$������ƿ�У���0.0500mol/L������Һ���еζ������ı���Һ20.00mL��
��ش��������⣺
��1��������Ʒ���õ�����Ϊ������ƽ���������ƽ��������ƽ����������Ʒ��ϸ���ٷ�Ӧ����Ŀ��������Ӵ������ʹԭ�ϳ�ַ�Ӧ���ӿ췴Ӧ���ʣ�
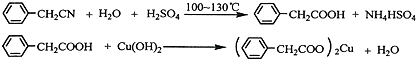
��2��װ��a��c�����÷ֱ���bd��e�����ţ����Զ�ѡ����
a����ȥSO2���� b����ȥ�����е�ˮ���� c��������������
d�������ڹ۲�������� e����ȥ��Ӧ����������
��3��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ����ʹ��Ӧ���ɵ�SO2ȫ������dװ���У�ʹ�����ȷ��
��4��ͨ�������֪���û�ͭ��Ĵ���Ϊ50%��
��5��������ͼװ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ���Ǣڣ�����ţ���

��6������ԭװ��d�е���Һ��ΪBa��OH��2����õĻ�ͭ�����Ϊ+1%������ʵ���������ȷ�����ܵ�ԭ����Ҫ�п����е�CO2��Ba��OH��2��Ӧ����BaCO3������BaSO3��������BaSO4��
���� ��ʵ��ԭ���ǣ����ݻ�ͭ�����ȷֽ�����Ķ�����������IJⶨ��������������õ�ˮ���궨�������Ԫ���غ����ȷ����ͭ����������������䴿�ȣ�
��1����ȡ��ϸ�Ļ�ͭ����Ʒ1.840g����֪��ȷ��0.001g����Ҫѡ�������ƽ���������ı�������Լӿ컯ѧ��Ӧ���ʣ�
��2��Ũ������Խ�ˮ��ȥ�������Ը���ð�����ݵ����������ڿ������٣����ȵ�ͭ�����Գ�ȥ�����������
��3����������ȫ����������ʵ��ɰܵĹؼ���
��4����֪�����ķ�Ӧ��8CuFeS2+21O2$\frac{\underline{\;����\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2��I2+SO2+2H2O�TH2SO4+2HI���������ĵĵⵥ�ʵ����ʵ������CuFeS2�����ʵ������������ٸ�����Ʒ�������������������
��5����������͵��ʵ�֮�䷢��������ԭ��Ӧ���������ĵⵥ�ʵ�������ȷ�������������������ȷ����ͭ��Ĵ��ȣ�
��6��������̼�Ͷ�����������Ժ�����������Ӧ���ɰ�ɫ�����������ᱵ�ױ�����Ϊ���ᱵ��
��� �⣺��ʵ��ԭ���Ǹ��ݻ�ͭ�����ȷֽ�����Ķ�����������IJⶨ��������������õ�ˮ���궨�������Ԫ���غ����ȷ����ͭ����������������䴿�ȣ�
��1����ȡ��ϸ�Ļ�ͭ����Ʒ1.840g����֪��ȷ��0.001g��������Ʒ���õ�����Ϊ������ƽ������Ʒ��ϸ���ٷ�Ӧ�����������ı������Ŀ����ʹԭ�ϳ�ַ�Ӧ���ӿ췴Ӧ���ʣ�
�ʴ�Ϊ��������ƽ������Ӵ������ʹԭ�ϳ�ַ�Ӧ���ӿ췴Ӧ���ʣ�
��2��װ��a�е�Ũ����������տ����е�ˮ������ͬʱ����ð�������ݵ����������������ͨ���������ȵ�ͭ�����Գ�ȥ�����������
�ʴ�Ϊ��bd��e��
��3����ͭ�����ȷֽ����ɶ��������һϵ�в���ֽ���Ϻ���Ȼͨ����������Խ������Ķ�������ȫ���ų�ȥ��ʹ�����ȷ��
�ʴ�Ϊ��ʹ��Ӧ���ɵ�SO2ȫ������dװ���У�ʹ�����ȷ��
��4����֪�����ķ�Ӧ��8CuFeS2+21O2$\frac{\underline{\;����\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2��I2+SO2+2H2O�TH2SO4+2HI��
��0.05mol/L������Һ���еζ������ı���Һ20mL�������ĵĵⵥ�ʵ���Ϊ0.05mol/L��0.02L=0.0010mol��
���ݷ�Ӧ����ʽ�õ���2I2��2SO2��CuFeS2�����Ի�ͭ���������0.0010mol��$\frac{1}{2}$��184g/mol��10=0.92g��
�����䴿���ǣ�$\frac{0.92g}{1.84g}$��100%=50%��
�ʴ�Ϊ��50%��
��5������ͼ3װ���������ʵ��װ��d�������âۣ�ԭ����ǰ��ͨ��Ŀ�����Ҳ��ռ��һ����������������Ը���Һ�������ĸ߶ȿ���ȷ�����ɵ�������������Ԫ���غ���ȷ����ͭ��Ĵ��ȣ�
�ʴ�Ϊ���ڣ�
��6�������е�CO2��Ba��OH��2��Ӧ��������BaCO3����������BaSO3��������BaSO4�����Ե������Եij��������ȶ������������������Ӧ���ɵİ�ɫ���������࣬
�ʴ�Ϊ�������е�CO2��Ba��OH��2��Ӧ����BaCO3������BaSO3��������BaSO4��
���� ���⿼����̽����ͭ��Ĵ��ȣ��漰��ʵ��ԭ���ķ���Ӧ�á����ȼ��㡢ʵ�鷽�������۵�֪ʶ����Ŀ�Ѷ��еȣ�������ؿ���ѧ���ķ������������������Ӧ�û���֪ʶ��������

��X��Y��W�ֱ�λ�ڲ�ͬ���ڣ�
��Z��W����ͬһ���壬��W��ԭ��������Z��������
��Y��Z��W������������֮��Ϊ17��
����˵������ȷ���ǣ�������
| A�� | ԭ�Ӱ뾶��С�����˳��Ϊr��X����r��Y����r��Z����r��W�� | |
| B�� | X��Y��Z�����γ����ӻ���������γɹ��ۻ����� | |
| C�� | Z�ֱ�����X��Y��W�γɶ��ֻ����� | |
| D�� | �뵥��W�Ƚϣ�����Z�������뵥��X���� |
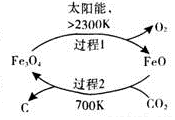 ������̼�Ļ��������ǻ��������о��ȵ㣮
������̼�Ļ��������ǻ��������о��ȵ㣮��1����̫���ܵ������£���CO2Ϊԭ����ȡ̿�ڵ�������ͼ1��ʾ���ܷ�Ӧ�Ļ�ѧ����ʽΪCO2$\frac{\underline{\;̫����\;}}{FeO}$C+O2��
��2����һ����CO2�����״�ȼ�ϵķ�����CO2+3H2?CH3OH+H2O����֪298K��101KPa�����£�
CO2��g��+3H2��g��?CH3OH��g��+H2O��l����H=-a kJ•mol-1��
2H2��g��+O2��g��=2H2O��l����H=-b kJ•mol-1��
CH3OH��g��=CH3OH��l����H=-c kJ•mol-1��
��CH3OH��l���ı�ȼ���ȡ�H=a+c-1.5b kJ•mol-1��
��3��CO2�������⻯�ϳɵ�̼ϩ�����ϳ���ϩ��ӦΪ2CO2��g��+6H2��g��?CH2=CH2��g��+4H2O��g����H��0�ں����ܱ������г���2mol CO2��n mol H2����һ�������·�����Ӧ��CO2��ת�������¶ȡ�Ͷ�ϱ�X=[$\frac{n��{H}_{2}��}{n��C{O}_{2}��}$]�Ĺ�ϵ��ͼ1��ʾ��

��ƽ�ⳣ��KA��KB
��T Kʱ��ij�ܱ���������������Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�������
| ʱ�䣨min�� Ũ�ȣ�mol•L-1�� | 0 | 10 | 20 | 30 | 40 | 50 |
| H2��g�� | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2��g�� | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2��g�� | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
A��ͨ��һ����H2 B��ͨ��һ����CH2=CH2C��������ʴ��� D����С�������
��ͼ2�л���CH2=CH2��Ũ���淴Ӧʱ��ı仯
��4���ڴ���M�������£�CO2��H2ͬʱ��������������Ӧ
A��2CO2��g��+6H2��g��?CH2=CH2��g��+4H2O��g����H��0
B��2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g����H��0
ͼ3����ϩ����ͬʱ���ڣ���ͬ�¶��µIJ��ʣ������460��ʱ��ϩ���ʽ��͵�ԭ������BD
A������M�Ļ��Խ��� B��A��Ӧ��ƽ�ⳣ�����
C�����ɼ��ѵ������� D��B��Ӧ�Ļ������
��5��Na2CO3��ҺҲͨ����������CO2�������£�H2CO3�ĵ�һ�����ڶ������볣���ֱ�ԼΪKa1=4��10-7��Ka2=5��10-11����0.5mol•L-1��Na2CO3��Һ��pH����12�������ǵڶ���ˮ���H2O�ĵ��룩
 ������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�