题目内容
2.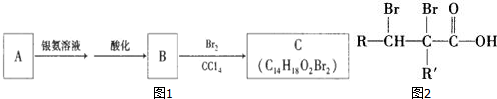 有机物A为茉莉香型香料.
有机物A为茉莉香型香料.(1)A分子中含氧官能团的名称醛基.
(2)C的分子结构可表示为图2(其中R和R′代表不同的烃基)
A的化学式是C14H18O,A可以发生的反应是a(填写序号字母)
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)己知含有烃基R的有机物R-0H与浓溴水反应产生的白色沉淀,则含有烃基R′的有机物R′-OH类别同于醇类.
(4)A分子结构中只有一个甲基,A的结构简式是
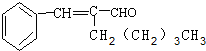 .
.(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是
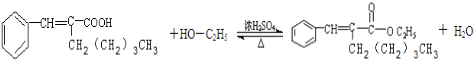 .
.(6)在A的多种同分异绝体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有3种.
分析 由(3)中含有烃基R的有机物R-0H与浓溴水反应产生的白色沉淀,则R为苯基,由C的分子式及其结构特点,可知C中R′基团为-C5H11,A分子结构中只有一个甲基,则R′基团为-CH2(CH2)3CH3,
由转化关系可知,A与银氨溶液发生氧化反应生成B,B与溴发生加成反应生成C,则A为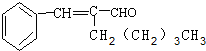 ,B为
,B为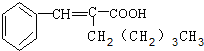 ,C的结构简式为
,C的结构简式为 ,据此解答.
,据此解答.
解答 解:由(3)中含有烃基R的有机物R-0H与浓溴水反应产生的白色沉淀,则R为苯基,由C的分子式及其结构特点,可知C中R′基团为-C5H11,A分子结构中只有一个甲基,则R′基团为-CH2(CH2)3CH3,
由转化关系可知,A与银氨溶液发生氧化反应生成B,B与溴发生加成反应生成C,则A为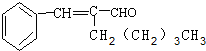 ,B为
,B为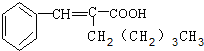 ,C的结构简式为
,C的结构简式为 .
.
解:(1)A为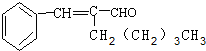 ,分子中含氧官能团为醛基,
,分子中含氧官能团为醛基,
故答案为:醛基;
(2)A为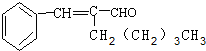 ,所以A的分子式为C14H18O;A含有碳碳双键和醛基,能够发生加成反应、还原反应和氧化反应,不能发生消去反应、酯化反应、水解反应,
,所以A的分子式为C14H18O;A含有碳碳双键和醛基,能够发生加成反应、还原反应和氧化反应,不能发生消去反应、酯化反应、水解反应,
故答案为:C14H18O;a;
(3)R′基团为-CH2(CH2)3CH3,R′-OH属于醇类,
故答案为:醇类;
(4)所以A的结构简式为: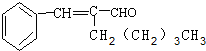 ,
,
故答案为: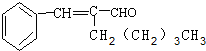 ;
;
(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是: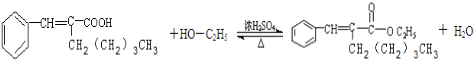 ,
,
故答案为: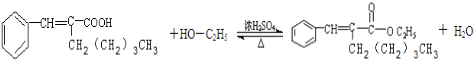 ;
;
(6)A的同分异构体中,含有三个甲基外,其余部分均与A相同,符合条件的A的同分异构体为,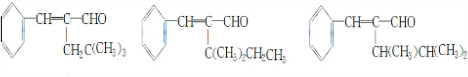 共3种,
共3种,
故答案为:3.
点评 本题考查有机物的推断和合成,注意根据C的结构特点、反应条件以及问题中信息进行推断,侧重于学生的分析能力和有机物的综合利用的考查.

练习册系列答案
相关题目
12.食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于这两种物质的说法正确的是( )
| A. | 炒菜时放入食盐并不破坏NaCl中的离子键 | |
| B. | HCl的电子式是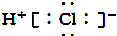 | |
| C. | HCl是共价化合物,但溶于水时电离出H+和Cl- | |
| D. | NaCl熔化时破坏共价键 |
13.戊醇的分子式为C5H120,若由戊烯与水发生加成反应生成戊醇,则生成的戊醇的结构最多有(不考虑立体异构 )( )
| A. | 5种 | B. | 7种 | C. | 8种 | D. | 9种 |
6.将1.5mL0.1mol•L-1Na2SO4溶液和1.0mL0.1mol•L-1BaCl2溶液混合后得到浊液a,过滤得到滤液b和白色沉淀c.下列分析不正确的是( )
| A. | 浊液a中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) | |
| B. | 若向滤液b中滴加0.01mol•L-1Na2SO4溶液,无明显现象 | |
| C. | 若向滤液b中滴加0.01mol•L-1BaCl2溶液,会出现白色沉淀 | |
| D. | 若向滤液b中滴加0.01mol•L-1AgNO3溶液,无明显现象 |
3.室温下,测得Ca(ClO)2溶液中c(ClO-)=0.1mol•L-1,下列判断中错误的是( )
| A. | 加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(Cl{O}^{-})}$增大 | |
| B. | 溶液中c(ClO-)>c(HClO)>c(OH-)>c(H+) | |
| C. | 溶液中2c(Ca2+)+c(H+)=c(ClO-)+c(OH-) | |
| D. | 若溶液的pH=l2,则c(ClO-)的水解百分率约为9.1% |
4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn+MnO2+H2O=ZnO+Mn(OH)2,下列说法中,错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+2H2O+2e-=Mn(OH)2+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
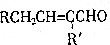 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基) ;C中含有的官能团为碳碳双键、醛基(写名称).
;C中含有的官能团为碳碳双键、醛基(写名称). .
.