题目内容
4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn+MnO2+H2O=ZnO+Mn(OH)2,下列说法中,错误的是( )| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+2H2O+2e-=Mn(OH)2+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
分析 根据电池总反应式为:Zn+MnO2+H2O═ZnO+Mn(OH)2,可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═ZnO+H2O,MnO2为原电池的正极,发生还原反应,正极反应为MnO2+2H2O+2e-═Mn(OH)2+2OH-,以此解答该题.
解答 解:A、根据总反应可知Zn失去电子被氧化,为原电池的负极,故A正确;
B、根据电池总反应式为:Zn+MnO2+H2O═ZnO+Mn(OH)2,可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═ZnO+H2O,MnO2为原电池的正极,发生还原反应,正极反应为MnO2+2H2O+2e-═Mn(OH)2+2OH-,故B正确;
C、原电池中,电子由负极经外电路流向正极,故C错误;
D、负极反应为Zn-2e-+2OH-═ZnO+H2O,外电路中每通过O.2mol电子,消耗的Zn的物质的量为0.1mol,质量为0.1mol×65g/mol=6.5g,所以锌的质量理论上减少6.5 g,故D正确.
故选C.
点评 本题考查化学电源的工作原理,题目难度不大,注意电极反应方程式的书写和判断.

练习册系列答案
相关题目
15.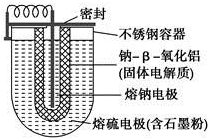 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
2Na(l)+S8(l)$?_{放电}^{充电}$Na2Sn.下列说法不正确的是( )
 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为2Na(l)+S8(l)$?_{放电}^{充电}$Na2Sn.下列说法不正确的是( )
| A. | 外室熔融硫中添加石墨粉主要是为了增强导电性 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时阳极反应式为8S-16e-═nS8 | |
| D. | 充电时钠极与外接电源的正极相连 |
12.下列物质属于纯净物的是( )
| A. | 氯乙烯 | B. | 汽油 | C. | 牛奶 | D. | 聚乙烯 |
19.表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.
(1)①-⑩中,最活泼的金属元素是Na(写元素符号,下同);最不活泼的元素是Ar;可作半导体材料的元素是Si;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是N.
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)③的最低价气态氢化物分子中的化学键类型为极性键(填“极性键”或“非极性键”),该分子的空间构型为为V形,③的最低价气态氢化物比⑧的最低价气态氢化物沸点高(填“高”或“低”),原因是H2O分子之间含氢键
(5)元素的非金属性:①> ⑦(填“>”或“<”).
(6)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化物反应的化学方程式为NaOH+HClO4=NaClO4+H2O.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)③的最低价气态氢化物分子中的化学键类型为极性键(填“极性键”或“非极性键”),该分子的空间构型为为V形,③的最低价气态氢化物比⑧的最低价气态氢化物沸点高(填“高”或“低”),原因是H2O分子之间含氢键
(5)元素的非金属性:①> ⑦(填“>”或“<”).
(6)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化物反应的化学方程式为NaOH+HClO4=NaClO4+H2O.
9.由A、B两种气态烃组成的混合气体,对H2 的相对密度为17,常温常压下,取这两种混合气体10ml与80ml氧气(过量)混合,当完全燃烧后恢复到原状态时,测得气体的体积为70ml,则两种气态烃的可能组成为( )
| A. | CH4和C2H4 | B. | C2H4和C3H4 | C. | C2H4和C2H6 | D. | C3H6和C2H4 |
16.下列说法正确的是( )
| A. | C-O键的极性比N-O键的极性大 | |
| B. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
13.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子.根据以上叙述,下列说中正确的是( )
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | 上述四种元素的原子半径大小为W<X<Y<Z |
14.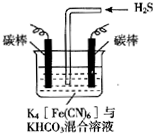 电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
 电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-=[Fe(CN)6]3- | |
| B. | 电解过程中阴极区溶液的pH变大 | |
| C. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| D. | 通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓ |
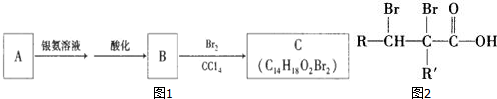 有机物A为茉莉香型香料.
有机物A为茉莉香型香料.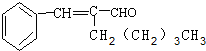 .
.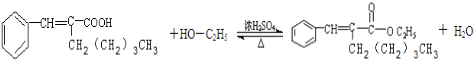 .
.