题目内容
12.食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于这两种物质的说法正确的是( )| A. | 炒菜时放入食盐并不破坏NaCl中的离子键 | |
| B. | HCl的电子式是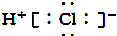 | |
| C. | HCl是共价化合物,但溶于水时电离出H+和Cl- | |
| D. | NaCl熔化时破坏共价键 |
分析 A.食盐溶于水破坏化学键;
B.HCl为共价化合物;
C.HCl是强电解质在水中完全电离;
D.NaCl为离子化合物.
解答 解:A.食盐溶于水,电离出自由移动的离子,破坏化学键,故A错误;
B.HCl为共价化合物,电子式为 ,故B错误;
,故B错误;
C.HCl是强电解质在水中完全电离,所以溶于水时电离出H+和Cl-,故C正确;
D.NaCl为离子化合物,只含有离子键,不含共价键,故D错误.
故选C.
点评 本题考查较为综合,涉及化学键、电子式等知识的考查,侧重于基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
3.某主族元素X的电子式为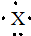 ,则该元素组成的以下物质中,化学式肯定错误的是( )
,则该元素组成的以下物质中,化学式肯定错误的是( )
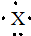 ,则该元素组成的以下物质中,化学式肯定错误的是( )
,则该元素组成的以下物质中,化学式肯定错误的是( )| A. | 含氧酸的化学式可能为HXO3 | B. | 含氧酸的化学式可能为H3XO4 | ||
| C. | 气态氢化物化学式为XH5 | D. | 最高价氧化物的化学式为X2O5 |
20. 一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )
一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )
 一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )
一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )| A. | 反应的化学方程式为A(g)+B(g)?D(g) | |
| B. | 反应开始到10s,用B表示的反应速率为0.079mol/(L•s) | |
| C. | 在10s时,D的体积分数为71.8% | |
| D. | 反应开始到10s时,A的转化率为79% |
7.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 丁溶液为短周期元素中最高价氧化物对应水化物中碱性最强的物质.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 1mol甲与足量的乙完全反应共转移了1mol电子 | |
| D. | 甲、乙、丙、丁、戊、己中含有的共价键的物质只有乙、丙、己 |
17.下列说法正确的是( )
| A. | 含C=C的物质一定是烯烃 | B. | 最简式为C3H6的物质一定是丙烯 | ||
| C. | CH≡CCH2Cl属于不饱和烃 | D. | 烯烃中一定含C=C |
4.下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是A(填序号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
请写出 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式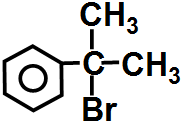 .
.
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
请写出
 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式 .
.
1.研究有机物一般经过以下几个基本步骤:分离、提纯→确定最简式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是( )
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 燃烧法是研究确定有机物成分的有效方法 | |
| C. | 1H核磁共振谱通常用于分析有机物的相对分子质量 | |
| D. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |

 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是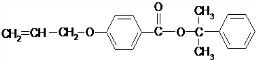 .
.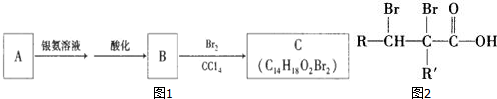 有机物A为茉莉香型香料.
有机物A为茉莉香型香料.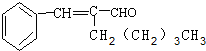 .
.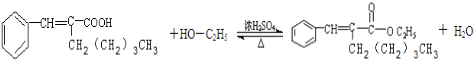 .
.