题目内容
6.将1.5mL0.1mol•L-1Na2SO4溶液和1.0mL0.1mol•L-1BaCl2溶液混合后得到浊液a,过滤得到滤液b和白色沉淀c.下列分析不正确的是( )| A. | 浊液a中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) | |
| B. | 若向滤液b中滴加0.01mol•L-1Na2SO4溶液,无明显现象 | |
| C. | 若向滤液b中滴加0.01mol•L-1BaCl2溶液,会出现白色沉淀 | |
| D. | 若向滤液b中滴加0.01mol•L-1AgNO3溶液,无明显现象 |
分析 将1.5mL0.1mol•L-1Na2SO4溶液和1.0mL0.1mol•L-1BaCl2溶液混合后,Na2SO4过量,BaCl2不足,反应后的滤液b中Na2SO4有剩余;浊液a中存在硫酸钡的溶解平衡;向滤液b中加入硫酸钠后无明显现象,加入氯化钡溶液后会生成硫酸钡沉淀;加入硝酸银溶液后生成氯化银沉淀,据此进行解答.
解答 解:将1.5mL0.1mol•L-1Na2SO4溶液和1.0mL0.1mol•L-1BaCl2溶液混合后,Na2SO4过量,BaCl2不足,
A.浊液a中的沉淀是BaSO4,存在的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq),故A正确;
B.在滤液b中Na2SO4过量,因此再加Na2SO4溶液,不会出现沉淀,故B正确;
C.该反应充分反应后,溶液中的成分有没反应完的Na2SO4,加入BaCl2生成硫酸钡沉淀,故C正确;
D.滤液b中含有Cl-,加入硝酸银后会生成AgCl白色沉淀,故D错误;
故选D.
点评 本题考查了难溶物溶解平衡、离子反应及其应用,题目难度中等,明确发生反应的实质为解答关键,注意掌握难溶物溶解平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是A(填序号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
请写出 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式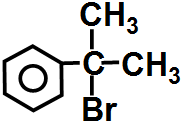 .
.
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
请写出
 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式 .
.
5.由乙烯推测丙烯(CH2═CH-CH3)的结构或性质正确的是( )
| A. | 分子中3个碳原子在同一条直线上 | B. | 分子中所有原子都在同一平面上 | ||
| C. | 能使溴的四氯化碳溶液褪色 | D. | 能使酸性高锰酸钾溶液褪色 |
1.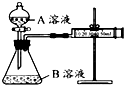 某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:
某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:
甲组:通过测定生成 CO2气体体积的方法来比较化学反应速率的大小.实验装置如图,实验时分 液漏斗中A溶液一次性放入B溶液中.
(注:实验中所用 KMnO4溶液均已加入相同量 H2SO4)
(1)写出锥形瓶中加入A溶液后发生反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.
(2)该组的实验目的是探究H2C2O4溶液浓度对化学反应速率的影响. 分析所给实验仪器,实现该实验目的还欠缺的仪器:秒表.
乙组:通过测定溶液褪色时间来判断反应速率快慢,实验记录如下表(各实验均在室温下进行):
(3)若实验①②是探究温度对化学反应速率影响,V1=30.0mL;设计实验④⑤的目的是探究产物是否对反应有催化作用.
(4)根据乙组的实验记录,下列结论正确的是C A.实验③中,V3=10
B.实验①③说明反应速率只与 KMnO4 浓度有关
C.根据实验①⑤可推出实验①中的反应速率变化是:起初较小,后明显变大,又逐渐变小.
 某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:
某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:甲组:通过测定生成 CO2气体体积的方法来比较化学反应速率的大小.实验装置如图,实验时分 液漏斗中A溶液一次性放入B溶液中.
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L-1 H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| ② | 2mL 0.1mol/L -1H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
(1)写出锥形瓶中加入A溶液后发生反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.
(2)该组的实验目的是探究H2C2O4溶液浓度对化学反应速率的影响. 分析所给实验仪器,实现该实验目的还欠缺的仪器:秒表.
乙组:通过测定溶液褪色时间来判断反应速率快慢,实验记录如下表(各实验均在室温下进行):
| 实验 编号 | 温度/℃ | 烧杯中所加的试剂及其用量 (mL) | 加入 少量固体 | 溶液褪色 时间(s) | |||
| 0.6mol•L-1 H2C2O4溶液 | H O | 0.2mol•L-1 KMnO4溶液 | 3mol•L-1 稀硫酸 | ||||
| ① | 25 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| ② | 50 | V1 | V2 | 30.0 | 20.0 | 无 | 1.0 |
| ③ | 25 | 15.0 | V3 | 15.0 | 10.0 | 无 | 3.6 |
| ④ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| ⑤ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
(4)根据乙组的实验记录,下列结论正确的是C A.实验③中,V3=10
B.实验①③说明反应速率只与 KMnO4 浓度有关
C.根据实验①⑤可推出实验①中的反应速率变化是:起初较小,后明显变大,又逐渐变小.
18.推动上千吨的火箭和进行长距离的太空飞行的巨大能量是从哪里来的?化学反应立下神功.火箭使用的燃料是偏二甲肼[(CH3)2NNH2],火箭升空时发生的化学反应为:C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑.下列有关该反应的说法正确的是( )
| A. | 偏二甲肼既是氧化剂又是还原剂 | |
| B. | 该反应进行时只有放热过程没有吸热过程 | |
| C. | 该反应中氮元素的化合价升高 | |
| D. | 该反应中每生成1mol CO2转移8mol电子 |
15.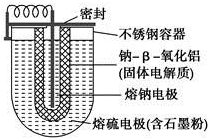 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
2Na(l)+S8(l)$?_{放电}^{充电}$Na2Sn.下列说法不正确的是( )
 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为2Na(l)+S8(l)$?_{放电}^{充电}$Na2Sn.下列说法不正确的是( )
| A. | 外室熔融硫中添加石墨粉主要是为了增强导电性 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时阳极反应式为8S-16e-═nS8 | |
| D. | 充电时钠极与外接电源的正极相连 |
16.下列说法正确的是( )
| A. | C-O键的极性比N-O键的极性大 | |
| B. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
 有机物A为茉莉香型香料.
有机物A为茉莉香型香料.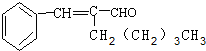 .
.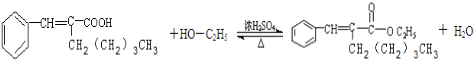 .
.