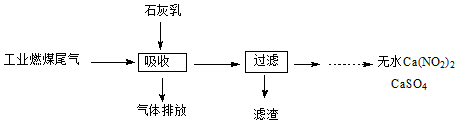
题目内容
8.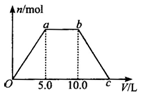 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:(1)a点之前的反应的离子方程式为Ba2++CO2+2OH-═BaCO3↓+H2O.
(2)a点到b点之间的反应的离子方程式是2OH-+CO2═CO32-+H2O、CO32-+H2O+CO2═2HCO3-.
(3)c点二氧化碳体积是15L.
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为1:1.
分析 向Ba(OH)2和NaOH的混合稀溶液中通入CO2,开始产生沉淀,故a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,b~c之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2,由方程式可知生成碳酸钡沉淀与碳酸钡溶解消耗二氧化碳的体积相等,可知c点二氧化碳的体积,根据氢氧化钡、氢氧化钠消耗二氧化碳体积计算溶液中Ba(OH)2和NaOH的浓度之比,据此分析解答.
解答 解:向NaOH和Ba(OH)2的混合稀溶液中通入CO2,开始产生沉淀,故a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,b~c之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2.
(1)由上述分析可知,a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,离子方程式为:Ba2++CO2+2OH-═BaCO3↓+H2O,故答案为:Ba2++CO2+2OH-═BaCO3↓+H2O;
(2)a~b之间的反应:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,离子方程式为:2OH-+CO2═CO32-+H2O;CO32-+H2O+CO2═2HCO3-,故答案为:2OH-+CO2═CO32-+H2O;CO32-+H2O+CO2═2HCO3-;
(3)由方程式可知生成碳酸钡沉淀与碳酸钡溶解消耗二氧化碳的体积相等,可知c点二氧化碳的体积为10L+5L=15L,故答案为:15;
(4)氢氧化钡、氢氧化钠消耗二氧化碳体积分别为5L、5L,结合方程式可知,溶液中Ba(OH)2和NaOH的浓度之比为1:1,故答案为:1:1.
点评 本题以化学反应图象形式考查反应方程式的有关计算,明确各阶段发生的反应是关键,难度中等.

| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 500℃左右比在室温时更有利于提高合成氨的转化率 | |
| C. | 硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 | |
| D. | 对2HI?H2+I2平衡体系增加压强使颜色变深 |
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$.
(2)T℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-7 |
| ③ | 0.90 | 3.24×10-7 |
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
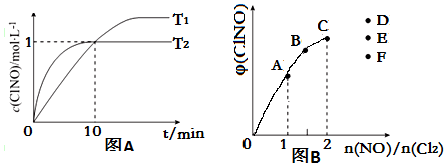
①温度为T1时,能作为该反应达到平衡的标志的有bdf;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=0.05mol•L-1•min-1;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=2L/mol(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是C点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的F点.
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 大气中二氧化碳含量的增多是造成“温室效应”的主要原因 |
| A. | 外观 | B. | 分散质粒子的大小 | ||
| C. | 是否能通过滤纸 | D. | 是否有丁达尔效应 |