题目内容
19.回答下列问题:(1)将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)?xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,
c(A):c(B)=3:5,C的反应速率是0.1mol•L-1•min-1.
①A在5min末的浓度是0.75mol/L.
②v(B)=0.05mol/(L•min).
③x=2.
(2)在25℃时,向100mL含氯化氢14.6g的盐酸溶液中,放入5.6g纯铁粉,反应进行到2min末收集到氢气1.12L(标准状况),在此后又经过4min,铁粉完全溶解.若不考虑溶液体积的变化,则:
①前2min内用FeCl2表示的平均反应速率是0.25mol/(L•min).
②后4min内用HCl表示的平均反应速率是0.25mol/(L•min).
③前2min与后4min相比,反应速率前2分钟较快,其原因是在其他条件不变时,增大反应物的浓度,反应速率增大,随着反应进行,反应物的浓度逐渐减小,因而v随之减小.
分析 (1)将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):n n 0 0
变化量(mol):1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,据此解答;
(2)①根据氢气的体积计算生成的氯化亚铁的物质的量,再利用反应速率公式计算氯化亚铁的平均反应速率;
②先算出2min后氢离子的物质的量的变化量,再根据平均反应速率公式计算;
③根据浓度与反应速率的关系分析.
解答 解:(1)将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):n n 0 0
变化量(mol):1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得:n=3,
①此时A的浓度c(A)=$\frac{(3-1.5)mol}{2L}$=0.75mol/L,
故答案为:0.75mol/L;
②5min末用B表示的平均反应速率为:v(B)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
③C的反应速率是0.1mol•L-1•min-1,则:$\frac{\frac{0.5xmol}{2L}}{5min}$=0.1mol/(L•min),解得:x=2,
故答案为:2;
(2)①反应前氯化亚铁的物质的量为0,
Fe+2HCl=FeCl2 +H2 ↑
56g 1mol 22.4L
2.8g 0.05mol 1.12L
v(FeCl2 )=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.05mol}{0.1L}}{2min}$=0.25 mol/(L.min),
故答案为:0.25 mol/(L•min);
②反应前氯化氢的物质的量为:$\frac{14.6g}{36.5g/mol}$=0.4mol,铁的物质的量为:$\frac{5.6g}{56g/mol}$,结合方程式知氯化氢过量,通过①知,前两分钟,铁反应消耗2.8g,还剩2.8g;2min-4min时,铁反应了2.8g,
Fe+2HCl=FeCl2 +H2 ↑
56g 2 mol
2.8g 0.1mol
所以氯化氢的物质的量的变化量为0.1mol,
所以4min内用HCl表示的平均反应速率为:v(HCl )=$\frac{\frac{0.1mol}{0.1L}}{4min}$=0.25 mol/(L•min),
故答案为:0.25 mol/(L•min);
③根据同一反应、同一时间段内中,各物质的反应速率之比等于计量数之比,所以前两分钟内,氯化氢的平均反应速率为0.5mol/(L.min);2min-4min时,氯化氢的平均反应速率为0.25 mol/(L.min),
所以前两分钟内反应速率快,原因是:随着反应的进行,氢离子的浓度不断减小,所以反应速率降低.
故答案为:前2分钟快; 在其他条件不变时,增大反应物的浓度,反应速率增大,随着反应进行,反应物的浓度逐渐减小,因而v随之减小.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.

| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267kJ/mol | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ/mol | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534kJ/mol | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol |
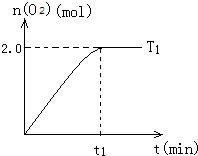 一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:
一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
(2)T1温度下,该反应的平衡常数表达式为:K=$\frac{{c}^{2}({H}_{2})×c({O}_{2})}{{c}^{2}({H}_{2}O)}$
(3)在T2温度时,K=0.4,T1> T2(填“>”“<”“=”)
(4)T1温度下,t1时刻达到平衡时的图象大致为:(见图I)
请在图I中画出降温至T0后,t0min达到平衡时的大致图象,并作必要的简单标注.
(5)H2可作氢氧燃料电池的反应物质,请写出在酸性介质中,氢氧燃料电池的负极反应式:H2-2e-=2H+.
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:
①C(s)+O2 (g)=CO2 (g)△H=-393.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2 (g)=H2O (g)△H=-241.8kJ•mol-1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol,该反应的化学平衡常数K随温度的升高将增大(填“增大”、“减小”或“不变”).
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.在甲、乙两个恒容密闭容器中,起始时按照表数据进行投料,在800℃时达到平衡状态,K=1.0.
| H2O | CO | CO2 | H2 | |
| 甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙 n/mol | 0.20 | 0.20 | 0 | 0 |
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸钠,写出工作时正极的电极反应式:O2+4e-+2CO2=2CO32-,若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下)6.72L.
(4)将(2)中生成的混合气用过量的NaOH溶液吸收,得到的溶液中有一种溶质可以水解,请写出其水解的离子方程式:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
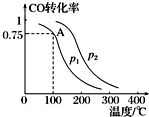 利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示.
利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示.
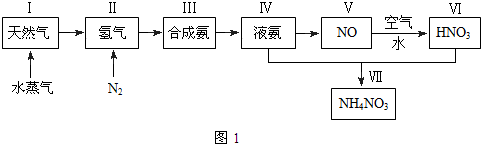
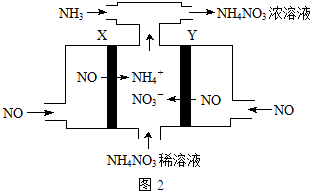
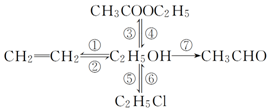 写出下列各物质相互转化的化学方程式,并说明各步的反应类型.
写出下列各物质相互转化的化学方程式,并说明各步的反应类型.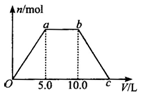 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答: