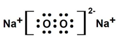题目内容
17.空气污染问题日益引起全民关注.(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是bc(填字母序号).
a.PM2.5主要来源于火力发电、工业生产、汽车尾气bc排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2.
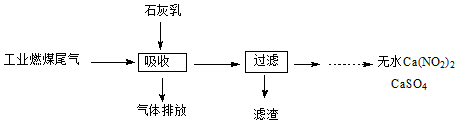
①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4.
②CaSO4可以调节水泥的硬化时间.尾气中SO2与石灰乳反应生成CaSO4的化学方程式为2SO2+O2+2Ca(OH)2═2CaSO4+2H2O.
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.
分析 (1)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5;
(2)①硫酸型酸雨形成过程是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸;
②尾气中SO2与氧气和石灰乳反应生成CaSO4和水;
③尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,结合氧化还原反应的特征书写.
解答 解:(1)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,故a正确;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质,故b错误;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合,故c错误;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5,故d正确;
故选:bc;
(2)①硫酸型酸雨形成过程是SO2溶于水生成亚硫酸,SO2+H2O?H2SO3;再被空气中的氧气氧化成硫酸,2H2SO3+O2═2H2SO4,
故答案为:SO2+H2O?H2SO3,2H2SO3+O2═2H2SO4;
②尾气中SO2与氧气和石灰乳反应生成CaSO4和水,反应方程式为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O故答案为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;
③尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,反应方程式为NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;故答案为:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.
点评 本题考查了PM2.5、酸雨的形成、硫氮尾气的应用,难度不大,抓好基础是关键.

 全优点练单元计划系列答案
全优点练单元计划系列答案(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:
①C(s)+O2 (g)=CO2 (g)△H=-393.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2 (g)=H2O (g)△H=-241.8kJ•mol-1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol,该反应的化学平衡常数K随温度的升高将增大(填“增大”、“减小”或“不变”).
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.在甲、乙两个恒容密闭容器中,起始时按照表数据进行投料,在800℃时达到平衡状态,K=1.0.
| H2O | CO | CO2 | H2 | |
| 甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙 n/mol | 0.20 | 0.20 | 0 | 0 |
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸钠,写出工作时正极的电极反应式:O2+4e-+2CO2=2CO32-,若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下)6.72L.
(4)将(2)中生成的混合气用过量的NaOH溶液吸收,得到的溶液中有一种溶质可以水解,请写出其水解的离子方程式:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
| 容器编号 | 起始物质的量mol | 4分钟后平衡时的物质量mol | 平衡时放出的热量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4rmol/(L•min) | |
| B. | 平衡时,放出的热量:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
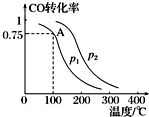 利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示.
利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示.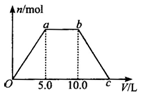 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答: