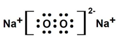题目内容
3.亚硝酸氯(ClNO)是有机合成中的重要试剂.亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)2ClNO(g).(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$.
(2)T℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k cn(ClNO),测得速率和浓度的关系如表:
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-7 |
| ③ | 0.90 | 3.24×10-7 |
(3)在2L的恒容密闭容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
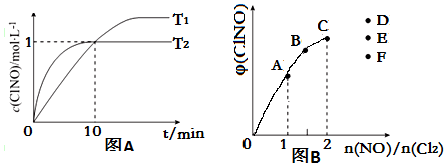
①温度为T1时,能作为该反应达到平衡的标志的有bdf;
a.容器体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.v(ClNO)=v(NO) f.NO与 ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=0.05mol•L-1•min-1;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K=2L/mol(注明单位).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是C点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的F点.
分析 (1)将方程式2②-①得方程式③,方程式扩大2倍,化学平衡常数为原来的平方,两个方程式相减,则化学平衡常数相除;
(2)将$\frac{②}{①}$得n,将n代入①中得k;
(3)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
②v(ClNO)=$\frac{1mol/L}{10min}$=0.1mol/(L.min),同一时间段内各物质的反应速率之比等于其计量数之比,据此计算v(Cl2);
③开始c(NO)=$\frac{4mol}{2L}$=2mol/L、c(Cl2)=$\frac{2mol}{2L}$=1mol/L,
该反应中2NO(g)+Cl2(g)?2ClNO(g)
开始(mol/L)2 1 0
反应(mol/L)1 0.5 1
平衡(mol/L)1 0.5 1
化学平衡常数K=$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO).c(C{l}_{2})}$;
(4)NO的物质的量越大其转化率越小;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小.
解答 解:(1)将方程式2②-①得方程式③,则K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$,
故答案为:$\frac{{{K}_{2}}^{2}}{{K}_{1}}$;
(2)$\frac{1.44×1{0}^{-7}}{3.6×1{0}^{-8}}$=$\frac{k(0.60)^{n}}{k(0.30)^{n}}$,n=2,将n代入①中得k=$\frac{3.6×1{0}^{-8}}{(0.30)^{2}}$mol-1•L•s-1=4.0×10-7 mol-1•L•s-1,
故答案为:2;4.0×10-7 mol-1•L•s-1;
(3)①a.恒容条件下,容器体积始终保持不变,不能据此判断平衡状态,故错误;
b.反应前后气体的物质的量减小,压强越小,当容器压强保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
c.化学平衡常数只与温度有关,温度不变化学平衡常数不变,不能据此判断平衡状态,故错误;
d.只有氯气有色,当气体颜色保持不变,正逆反应速率相等,反应达到平衡状态,故正确;
e.v(ClNO)=v(NO)时,反应方向未知,无法确定是否达到平衡状态,故错误;
f.NO与 ClNO的物质的量比值保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选bdf;
②v(ClNO)=$\frac{1mol/L}{10min}$=0.1mol/(L.min),同一时间段内各物质的反应速率之比等于其计量数之比,据此得v(Cl2)=$\frac{1}{2}$v(ClNO)=$\frac{1}{2}$×0.1mol/(L.min)=0.05mol/(L.min),
故答案为:0.05 mol•L-1•min-1;
③开始c(NO)=$\frac{4mol}{2L}$=2mol/L、c(Cl2)=$\frac{2mol}{2L}$=1mol/L,
该反应中2NO(g)+Cl2(g)?2ClNO(g)
开始(mol/L)2 1 0
反应(mol/L)1 0.5 1
平衡(mol/L)1 0.5 1
化学平衡常数K=$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO).c(C{l}_{2})}$=$\frac{{1}^{2}}{{1}^{2}×0.5}$L/mol=2L/mol,
故答案为:2L/mol;
(4)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,
故答案为:C;F.
点评 本题考查化学平衡计算、外界条件对化学平衡影响因素、化学平衡状态判断等知识点,侧重考查学生分析判断及计算能力,利用三段式法进行有关计算,注意(4)中当n(NO)/n(Cl2)=2时反应物的转化率相等且产物的含量最大,题目难度中等.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 点燃氢气等易燃性气体前,必须检验气体的纯度 | |
| B. | 用嘴吹灭酒精灯火焰 | |
| C. | 加热试管里的液体时,试管口对着他人 | |
| D. | 把水注入浓硫酸中进行稀释 |
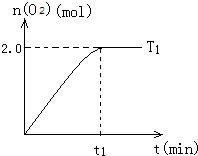 一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:
一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
(2)T1温度下,该反应的平衡常数表达式为:K=$\frac{{c}^{2}({H}_{2})×c({O}_{2})}{{c}^{2}({H}_{2}O)}$
(3)在T2温度时,K=0.4,T1> T2(填“>”“<”“=”)
(4)T1温度下,t1时刻达到平衡时的图象大致为:(见图I)
请在图I中画出降温至T0后,t0min达到平衡时的大致图象,并作必要的简单标注.
(5)H2可作氢氧燃料电池的反应物质,请写出在酸性介质中,氢氧燃料电池的负极反应式:H2-2e-=2H+.

【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示:
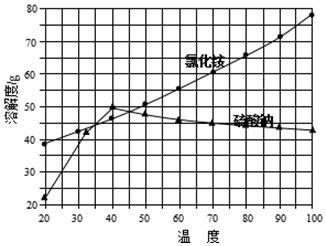
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式:(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4.
(2)欲制备10.7g NH4Cl,理论上需NaCl质量为11.7g.
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有玻璃棒、烧杯、蒸发皿.
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为35℃.
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
| 操作步骤 | 现象 | 结论 |
| 取少量氯化铵产品于试管底部,加热 | 如果试管底部没有固体剩余 | 表明氯化铵产品纯净 |
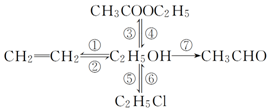 写出下列各物质相互转化的化学方程式,并说明各步的反应类型.
写出下列各物质相互转化的化学方程式,并说明各步的反应类型.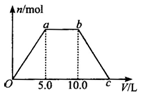 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答: