题目内容
6.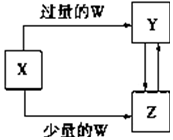 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | NaAlO2溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
分析 A、W为稀硫酸、X为NaAlO2溶液,则Y为硫酸铝,Z为氢氧化铝;
B、W为稀硝酸、X为Fe,则Y为硝酸铁,Z为硝酸亚铁;
C、W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化;
D、W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁;
解答 解:A、W为稀硫酸、X为NaAlO2溶液,则Y为硫酸铝,Z为氢氧化铝,硫酸铝通入二氧化碳转化为氢氧化铝,氢氧化铝与硫酸反应生成硫酸铝,所以可以实现以上转化,故A不选;
B、W为稀硝酸、X为Fe,则Y为硝酸铁,Z为硝酸亚铁,硝酸铁与铁反应生成硝酸亚铁,硝酸亚铁与硝酸反应生成硝酸--所以可以实现以上转化,故B不选;
C、W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化,碳酸钙和二氧化碳、水反应生成碳酸氢钙,碳酸氢钙分解生成碳酸钙,故C不选;
D、W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁,不能生成不同价态的化合物,故D错误;
故选D.
点评 本题考查元素化合物的推断,解题关键是根据已知信息结合化合物的性质分析、尝试确定各物质,各物质确定后抓住化学性质解决问题.本题涉及知识点较多,难度较大.

练习册系列答案
相关题目
16.研究发现,火力发电厂释放出的尾气是造成雾霾的主要原因之一,CO是其主要成分之一,为减少对环境造成的影响,发电厂试图采用以下方法将CO进行合理利用,以获得重要工业产品.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
①反应0~2min末的平均速率v(COCl2)=0.1mol/(L?min).
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2?COCl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数.
B.使用合适的催化剂可以增大反应体系中COCl2的体积分数
C.若改变某个反应条件,反应体系中COCl2的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡.
(3)用CO和H2在高温下合成C5H12(汽油的一种成分).已知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(1)表示L一定时,CO的转化率随X的变化关系,则C代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.
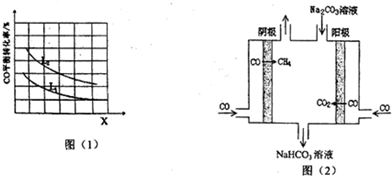
(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1mol CH4,理论上需要消耗CO的物质的量为4mol.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2?COCl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数.
B.使用合适的催化剂可以增大反应体系中COCl2的体积分数
C.若改变某个反应条件,反应体系中COCl2的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡.
(3)用CO和H2在高温下合成C5H12(汽油的一种成分).已知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(1)表示L一定时,CO的转化率随X的变化关系,则C代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.

(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1mol CH4,理论上需要消耗CO的物质的量为4mol.
17.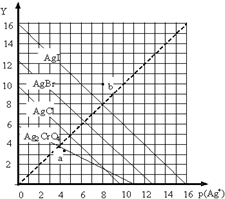 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )| A. | a点表示c(Ag+)=c(CrO42-) | |
| B. | b点可表示AgI的饱和溶液 | |
| C. | 该温度下AgI的Ksp约为1×10-16 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
14.下列叙述正确的是( )
| A. | 锥形瓶可用作加热的反应器 | |
| B. | 室温下,不能将浓硫酸盛放在铁桶中 | |
| C. | 在50mL量筒中配置0.1000mol•L-1碳酸钠溶液 | |
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
1.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 42g NaHCO3晶体中含有CO32-的数目为0.5NA | |
| B. | 1 mol OH-和17 g NH3所含的电子数相等 | |
| C. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| D. | 2.0g H216O与D216O的混合物中所含中子数为NA |
18.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO为8mol.下列说法正确的是( )
| A. | 保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7 mol | |
| D. | CO的平衡转化率为80% |
16.如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )


| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 产生1 g H2,消耗锌的质量65 g |
 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示: