题目内容
17.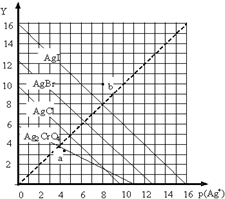 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )| A. | a点表示c(Ag+)=c(CrO42-) | |
| B. | b点可表示AgI的饱和溶液 | |
| C. | 该温度下AgI的Ksp约为1×10-16 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
分析 A.a点为Ag2CrO4饱和溶液,存在Ag2CrO4(s)?2Ag+(aq)+CrO42-(aq);
B.b点在AgI溶解平衡曲线的上方,为不饱和溶液;
C.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(I-)”,可计算Ksp;
D.纵横坐标的乘积越大,Ksp越小.
解答 解:A.a点为Ag2CrO4饱和溶液,存在Ag2CrO4(s)?2Ag+(aq)+CrO42-(aq),则a点表示c(Ag+)≠c(CrO42-),故A错误;
B.b点在AgI溶解平衡曲线的上方,Qc<Ksp,为不饱和溶液,曲线上的点为饱和溶液,故B错误;
C.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(I-)”,该温度下AgI的Ksp约为1×10-8×1×10-8=1×10-16,故C正确;
D.纵横坐标的乘积越大,Ksp越小,则Ksp(AgCl)>Ksp(AgBr),可知该温度下AgCl、AgBr饱和溶液中:c(Cl-)>c(Br-),故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握图中离子浓度、Ksp的关系为解答的关键,侧重分析与计算能力的考查,注意Ksp与纵横坐标的关系,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
10.下列粒子与NH4+的质子总数和电子总数相同的是( )
| A. | F- | B. | Ne | C. | H3O+ | D. | NH2- |
5.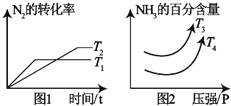 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
步骤一:氮气与氢气合成氨气;步骤二:氨气的催化氧化;步骤三:NO的氧化再水化.
请回答下列问题:
(1)对于N2(g)+3H2(g)═2NH3(g)△H1kJ/mol,满足如图1象:
①根据图△H1<0,T3<T4.(填“>”“<”“=”)
②若温度为T1且容积为2L的密闭容器下中,发生合成氨的反应,起始时通入2mol的N2和6mol的H2,10分钟达到平衡状态,此时NH3的体积分数为60%.则0到10min内用H2表示化学反应速率为0.225mol/(L•min),N2的转化率为75%,反应开始和平衡状态体系的压强之比等于8:5.T1温度下平衡常数K≈21.3,若升高温度K值减小.(填“增大”“减小”“不变”)
③若第②小问中反应体系达到平衡后,再通入1mol N2和3mol H2,则H2转化率增大.(填“增大”“减小”“不变”)
④若恒定温度为T1,容积为2L,则若开始通入2mol N2和2mol H2和2mol的NH3则反应开始时V正>V逆(填“>”“<”“=”),达到新的平衡状态后,再通入2mol N2,则N2的转化率降低.(填“升高”、“降低”或者“不变”)
⑤对于合成氨的体系中,既可以增大反应速率又可以提高H2的转化率的措施有增大压强和增大N2浓度.(填两点即可)
(2)已知:
则△H1=(a+3b-6c)kJ/mol,问题(1)第②小问中能量变化为9c-1.5a-4.5bkJ.
(3)已知:
①N2(g)+3H2(g)═2NH3(g)△H1kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2kJ/mol
③4NO(g)+3O2(g)+2H2O(g)═4HNO3(aq)△H3kJ/mol
则N2(g)+3H2(g)+4O2(g)═2HNO3(aq)+2H2O(l)△H=(△H1+0.5△H2+0.5△H3)kJ/mol(用a、b、c、△H2和△H3表示)
 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:步骤一:氮气与氢气合成氨气;步骤二:氨气的催化氧化;步骤三:NO的氧化再水化.
请回答下列问题:
(1)对于N2(g)+3H2(g)═2NH3(g)△H1kJ/mol,满足如图1象:
①根据图△H1<0,T3<T4.(填“>”“<”“=”)
②若温度为T1且容积为2L的密闭容器下中,发生合成氨的反应,起始时通入2mol的N2和6mol的H2,10分钟达到平衡状态,此时NH3的体积分数为60%.则0到10min内用H2表示化学反应速率为0.225mol/(L•min),N2的转化率为75%,反应开始和平衡状态体系的压强之比等于8:5.T1温度下平衡常数K≈21.3,若升高温度K值减小.(填“增大”“减小”“不变”)
③若第②小问中反应体系达到平衡后,再通入1mol N2和3mol H2,则H2转化率增大.(填“增大”“减小”“不变”)
④若恒定温度为T1,容积为2L,则若开始通入2mol N2和2mol H2和2mol的NH3则反应开始时V正>V逆(填“>”“<”“=”),达到新的平衡状态后,再通入2mol N2,则N2的转化率降低.(填“升高”、“降低”或者“不变”)
⑤对于合成氨的体系中,既可以增大反应速率又可以提高H2的转化率的措施有增大压强和增大N2浓度.(填两点即可)
(2)已知:
| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
(3)已知:
①N2(g)+3H2(g)═2NH3(g)△H1kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2kJ/mol
③4NO(g)+3O2(g)+2H2O(g)═4HNO3(aq)△H3kJ/mol
则N2(g)+3H2(g)+4O2(g)═2HNO3(aq)+2H2O(l)△H=(△H1+0.5△H2+0.5△H3)kJ/mol(用a、b、c、△H2和△H3表示)
6.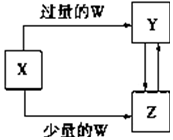 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | NaAlO2溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
7.常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )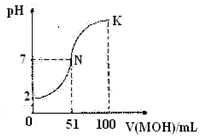

| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |