题目内容
16.如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )
| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 产生1 g H2,消耗锌的质量65 g |
分析 锌比铜活泼,锌为负极,发生氧化反应,铜为正极,发生还原反应,原电池工作时总反应为:Zn+H+=Zn2++H2↑,原电池是化学能转化为电能的装置,以此解答该题.
解答 解:A.锌为负极,Zn失电子发生氧化反应,故A正确;
B.原电池工作时总反应为:Zn+2H+=Zn2++H2↑,故B正确;
C.该装置为原电池,原电池是化学能转化为电能的装置,故C正确;
D.原电池工作时总反应为:Zn+2H+=Zn2++H2↑,产生1molH2,消耗锌的质量65g,故D错误;
故选D.
点评 本题考查原电池知识,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大,注意把握原电池的工作原理.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
6.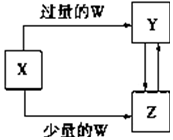 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | NaAlO2溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
7.常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )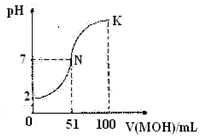

| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
4.加入HCl溶液后,溶液中离子数目会减少的是( )
| A. | CO32- | B. | Al3+ | C. | SO42- | D. | NO3- |
11.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、W在周期表的相对位置如图所示.X元素的最简单氢化物甲能使湿润的红色石蕊试纸变蓝,W元素是海水溶质中的一种主要的元素,X和Y同周期,Y与Z的最外层电子数之和与W的最外层电子数相等.请回答下列问题:
(1)W位于周期表中的位置第三周期第VIIA族.
(2)Z和W组成物质的电子式是 .
.
(3)Y、Z、W的常见离子的半径大小顺序是r(Cl-)>r(O2-)>r(Na+)(填离子符号)
(4)X与Y的第一电离能比较,第一电离能较大的是氮(填元素名称),其原因是N原子的2p轨道有3个电子,2p轨道半满.
(5)X的最简单氢化物甲与Y的单质在有催化剂存在时可以发生,写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
| X | |||
| W |
(2)Z和W组成物质的电子式是
 .
.(3)Y、Z、W的常见离子的半径大小顺序是r(Cl-)>r(O2-)>r(Na+)(填离子符号)
(4)X与Y的第一电离能比较,第一电离能较大的是氮(填元素名称),其原因是N原子的2p轨道有3个电子,2p轨道半满.
(5)X的最简单氢化物甲与Y的单质在有催化剂存在时可以发生,写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
1.下列有关化学科学的说法中正确的是( )
| A. | 我们的祖先很早就学会了烧制陶瓷、冶炼金属、酿造酒类 | |
| B. | 化学研究的主要目的是认识分子 | |
| C. | 化学科学无法帮助研究人员了解疾病的病理 | |
| D. | 意大利化学家阿伏伽德罗提出了原子学说,为近代化学的发展奠定了基础 |
5.铅蓄电池的总反应为:PbO2(s)+Pb(s)+2H2SO4(aq) $?_{充电}^{放电}$ 2PbSO4(s)+2H2O(l)关于铅蓄电池的说法正确的是( )
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-═PbSO4(s) | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
6.下列物质中,属于电解质的是( )
| A. | H2 | B. | AlCl3 | C. | CH4 | D. | H2SO4 |