题目内容
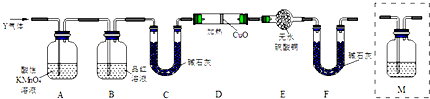
9.工业上用辉铜矿(主要成分Cu2S,含Fe3O4、SiO2杂质)为原料,生产硫酸铜晶体的工艺流程如下: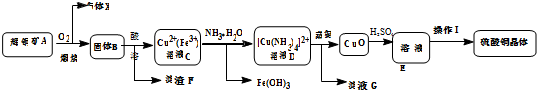
已知:①固体B为氧化物组成的混合物 ②[Cu(NH3)4]2+(aq)═Cu2+(aq)+4NH3(aq)
(1)气体X是SO2,高温下在过量空气中煅烧辉铜矿时,Cu2S发生反应的方程式为:Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2.
(2)固体B酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+,不用浓硫酸的原因是浓硫酸与Fe2+反应会生成对环境有污染的SO2.
(3)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干.
(4)0.80gCuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.

①试确定200℃时固体物质的化学式CuSO4•H2O;
②取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为CuSO4 $\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑.把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为CuSO4 $\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑;,其存在的最高温度是102℃.
分析 辉铜矿通入氧气充分煅烧,生成二氧化硫气体和固体CuO、Fe3O4,加入盐酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,[Cu(NH3)4]2+经加热可得到CuO,加入硫酸得到硫酸铜溶液,经蒸发浓缩、冷却结晶后可得到硫酸铜晶体,
(1)根据图示,Cu2S与O2的反应为氧化还原反应生成铜和二氧化硫;
(2)固体B为氧化物组成的混合物,酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;根据浓硫酸氧化Fe2+反应会生成对环境有污染的SO2;
(3)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干;
(4)①由图分析可知,CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解;在200℃时失去的水的质量为0.80g-0.57g=0.23g,根据相应的化学方程式即可确定此时固体物质的化学式;
②温度为570℃灼烧得到的黑色粉末是CuO,氧化性气体则为SO3,反应方程式为:CuSO4 $\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO4•5H2O;根据图象分析其存在的最高102℃.
解答 解:辉铜矿通入氧气充分煅烧,生成二氧化硫气体和固体CuO、Fe3O4,加入盐酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,[Cu(NH3)4]2+经加热可得到CuO,加入硫酸得到硫酸铜溶液,经蒸发浓缩、冷却结晶后可得到硫酸铜晶体,
(1)根据图示,Cu2S与O2的反应为氧化还原反应生成铜和二氧化硫,方程式为:Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2,所以气体X是SO2;
故答案为:SO2;Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2;
(2)固体B为氧化物组成的混合物,酸溶时加入稀硫酸和H2O2,目的是溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;因为浓硫酸氧化Fe2+反应会生成对环境有污染的SO2,所以不用,
故答案为:溶解CuO、Fe3O4,并将Fe2+氧化为Fe3+;浓硫酸与Fe2+反应会生成对环境有污染的SO2;
(3)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、过滤、洗涤、烘干,
故答案为:过滤、洗涤;
(4)①CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
0.80g 0.80g-0.57g=0.23g
$\frac{250}{18n}=\frac{0.80g}{0.23g}$,解得n=4,
200℃时该固体物质的化学式为CuSO4•H2O,
故答案为CuSO4•H2O;
②温度为570℃灼烧得到的黑色粉末应是CuO,氧化性气体则为SO3,反应方程式为:CuSO4 $\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO4•5H2O;其存在的最高102℃,
故答案为:CuSO4 $\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑; CuSO4•5H2O;102℃.
点评 本题考查了物质分离提纯的方法和流程判断,主要是物质性质的理解应用和实验基本操作,掌握基础是关键,题目难度中等.

| X | Y | 现象 | 装置 | |
| A | 氯水 | 石蕊 | 溶液先变红后褪色 | 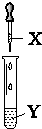 |
| B | 氨水 | AgNO3溶液 | 先产生沉淀后逐渐溶解 | |
| C | NaOH溶液 | AlCl3溶液 | 产生白色沉淀且不消失 | |
| D | 双氧水 | 酸性淀粉KI溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 加入碳酸锰的目的是除去Fe3+ | |
| B. | 常温下pH=4时,Fe3+已除尽 | |
| C. | Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=2.73×10-23 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
| A. | RO | B. | R2Om | C. | R2Om-n | D. | R2O2m-n |
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| D. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
| A. | $\frac{12n}{m}$ | B. | $\frac{60n}{m}$ | C. | $\frac{11m}{120n}$ | D. | $\frac{120n}{11m}$ |

 目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.
目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.