题目内容
7.煤的气化反应主要是:反应I:C(s)+H2O(g)?CO(g)+H2(g)△H1>0;反应Ⅱ:CO2(g)+H2O(g)?CO2(g)+H2(g)△H2<0,在850℃时,K=1.
(1)①反应I的正反应的活化能Ea正和△H1的大小关系为Ea正大于△H1(填“大于”“等于”或“小于”),温度的改变对正、逆反应速率影响较大的是正(填“正”或“逆”)反应速率
②将一定量CO和H2O混合气放人一个恒容绝热的闭容器内发生反应Ⅱ(初始温度850℃),以下可以为可逆反应Ⅱ达到平衡标志的是B.
A.当混合气的平均相对分子质量不随时间而变化时
B.当v(CO)正=v(H2)逆时
C.当c(CO2)•c(H2)=c(CO)•c(H2O)时
D.当混合气的压强不随时间而变化时.
分析 (1)①△H1=Ea正-Ea逆>0,所以Ea正>△H1;温度的改变对吸热反应方向影响较大,由此分析解答;
(2)达平衡状态时各组分的浓度保持不变,正逆反应速率相等,由此分析解答.
解答 解:(1)①△H1=Ea正-Ea逆>0,所以Ea正>△H1;温度的改变对吸热反应方向影响较大,所以对正反应方向影响较大,故答案为:大于;正;
(2)A.两边气体的计量数相等,混合气的平均相对分子质量始终不随时间而变化,故错误;
B.当v(CO)正=v(H2)逆=v(CO)逆,正逆反应速率相等,故正确;
C.当c(CO2)•c(H2)=c(CO)•c(H2O)时,并不是浓度不变的状态,故C错误;
D.两边气体的计量数相等,混合气的压强一直不随时间而变化,故错误;
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大,应注意根据平衡状态的特点分析.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
17.化学科学需要借助化学专用语言来描述,下列有关化学用语不正确的是( )
| A. | 甲烷分子的球棍模型 | |
| B. | Cl-的结构示意图 | |
| C. | 中子数为8的碳原子的核素符号为12C | |
| D. | 中子数为1的氢原子的核素符号为21H |
18.X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为同位素.
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)反应3X2(g)+P2(g) 2PX3(g)过程中的能量变化如图所示,回答下列问题.
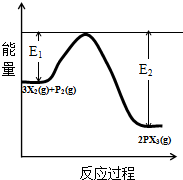
①该反应是放热反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?不影响,原因是催化剂不改变平衡的移动(从能量说明)
| X | Y | Z | W | R | P | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)反应3X2(g)+P2(g) 2PX3(g)过程中的能量变化如图所示,回答下列问题.

①该反应是放热反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?不影响,原因是催化剂不改变平衡的移动(从能量说明)
12.用下列步骤制取物质,可以达到目的是( )
| A. | Al$\stackrel{氧气,加热}{→}$Al2O3$\stackrel{硝酸}{→}$Al(NO3)3$\stackrel{加热蒸干}{→}$硝酸铝晶体 | |
| B. | Cu$\stackrel{氧气,加热}{→}$CuO$\stackrel{稀硫酸}{→}$CuSO4$\stackrel{蒸干结晶}{→}$胆矾 | |
| C. | Fe$\stackrel{氯气}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{加热}{→}$Fe2O3 | |
| D. | FeSO4溶液$\stackrel{硫化氢、过滤}{→}$FeS |
19.某合金由铜、镁两种金属组成,现取合金5.0g于烧杯中,将100g稀盐酸分两次加人到烧杯中,所得数据如下表.
请计算:
(1)合金中镁的质量为4g;
(2)所用稀盐酸的溶质质量分数.
| 次数 | 第1次 | 第2次 |
| 加入稀盐酸的质量/g | 50 | 50 |
| 剩余固体的质量/g | 2.6 | 1 |
(1)合金中镁的质量为4g;
(2)所用稀盐酸的溶质质量分数.
17.在H2与Cl2生成HCl的反应中,已知H-H键、Cl-Cl、和H-Cl键的键能分别为akJ/mol、bkJ/mol、ckJ/mol,则生成1molHCl放出的能量为( )
| A. | (c-a-b)kJ | B. | (a+b-c)kJ | C. | (2c-a-b)kJ | D. | $\frac{2c-a-b}{2}$kJ |