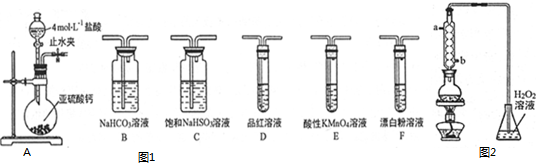
题目内容
18.X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:| X | Y | Z | W | R | P | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)反应3X2(g)+P2(g) 2PX3(g)过程中的能量变化如图所示,回答下列问题.
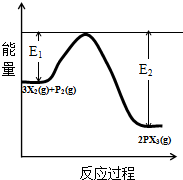
①该反应是放热反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?不影响,原因是催化剂不改变平衡的移动(从能量说明)
分析 X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;W有-2价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;P有-3、+5价,处于VA族,原子半径小于Cl,故P为N元素.
解答 解:X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;W有-2价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;P有-3、+5价,处于VA族,原子半径小于Cl,故P为N元素.
(1)R在自然界中有质量数为35和37的两种核素,中子数不同,二者互为同位素,
故答案为:同位素;
(2)Z为Na元素,钠与水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,R与Q两元素最高价氧化物水化物分别为HClO4、Al(OH)3,二者反应离子方程式为:3H++Al(OH)3═Al3++3H2O,
故答案为:2Na+2H2O=2NaOH+H2↑;3H++Al(OH)3═Al3++3H2O;
(3)Y为Si元素,R为Cl元素,同周期自左而右,非金属性增强,所以非金属性Si<Cl;
a.状态属于物理性质,不能说明元素的非金属性强弱,故a错误;
b.非金属越强,氢化物越稳定,稳定性XR>YX4,说明X的非金属性强,故b正确;
c.Y与R形成的化合物中Y呈正价,说明X吸引电子能力强,X的非金属性强,故c正确;
故答案为:Cl;bc;
(4)工业制取Y(Si)的单质的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(5)①由图可知,反应物总能量高于生成物总能量,则该反应是放热反应,故答案为:放热;
②催化剂不改变平衡的移动,不影响反应热,故答案为:不影响;催化剂不改变平衡的移动.
点评 本题考查结构性质位置关系应用、化学反应中能量变化,关键是根据原子半径、化合价推断元素,理解掌握元素周期律,注意金属性、非金属性强弱比较实验事实.

 名校课堂系列答案
名校课堂系列答案| A. | 至少存在5种离子 | |
| B. | CO32-、Al3+一定不存在,K+可能存在 | |
| C. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| D. | Cl-一定存在 |
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 一定条件下醋酸溶液的导电能力可能比稀硫酸强 | |
| C. | SO2的水溶液能导电,所以SO2是电解质 | |
| D. | 金刚石不导电,因此金刚石是非电解质 |
| A. | NF3 | B. | C${H}_{3}^{-}$ | C. | SO3 | D. | H3O+ |
| A. | 明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 | |
| C. | Li是最轻的金属,也是活动性较强的金属,是制造电池的理想物质 | |
| D. | 水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
| 含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 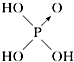 | 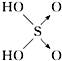 | 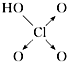 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
①H3PO3的结构式为
 ,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;
,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;②H3AsO3的结构式为
 ,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O. | A. | 两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染 | |
| B. | 二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸 | |
| C. | 两种气体都具有强氧化性,因此都能够使品红溶液褪色 | |
| D. | 两种气体溶于水都可以与水反应,且只生成相应的酸 |