题目内容
12.用下列步骤制取物质,可以达到目的是( )| A. | Al$\stackrel{氧气,加热}{→}$Al2O3$\stackrel{硝酸}{→}$Al(NO3)3$\stackrel{加热蒸干}{→}$硝酸铝晶体 | |
| B. | Cu$\stackrel{氧气,加热}{→}$CuO$\stackrel{稀硫酸}{→}$CuSO4$\stackrel{蒸干结晶}{→}$胆矾 | |
| C. | Fe$\stackrel{氯气}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{加热}{→}$Fe2O3 | |
| D. | FeSO4溶液$\stackrel{硫化氢、过滤}{→}$FeS |
分析 A.铝和氧气反应生成氧化铝,氧化铝和硝酸反应生成硝酸铝,硝酸铝水解生成氢氧化铝和硝酸,硝酸易挥发加热热蒸干得到水解产物氢氧化铝;
B.铜和氧气反应生成氧化铜,氧化铜和硫酸反应生成硫酸铜,硫酸铜水解生成硫酸是难挥发性酸,蒸发浓缩,冷却结晶得到晶体硫酸铜;
C.铁和氯气反应生成氯化铁,氯化铁和过量氨水反应生成氢氧化铁,加热分解得到氧化铁;
D.硫化亚铁溶于盐酸,盐酸酸性大于氢硫酸,硫酸亚铁和氢硫酸不能反应.
解答 解:A.铝和氧气反应生成氧化铝,4Al+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3,氧化铝和硝酸反应生成硝酸铝,Al2O3+6HNO3=Al(NO3)3+3H2O,硝酸铝水解生成氢氧化铝和硝酸,Al(NO3)3+3H2O?Al(OH)3+3HNO3,硝酸易挥发加热热蒸干得到水解产物氢氧化铝,不能得到硝酸铝晶体,故A错误;
B.铜和氧气反应生成氧化铜,2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,氧化铜和硫酸反应生成硫酸铜,CuO+H2SO4=CuSO4+H2O,CuSO4+H2O?Cu(OH)2+H2SO4,硫酸铜水解生成硫酸是难挥发性酸,蒸发浓缩,冷却结晶得到晶体硫酸铜,蒸干结晶得到硫酸铜,但不能得到硫酸铜晶体,故B错误;
C.铁和氯气反应生成氯化铁,2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,氯化铁和过量氨水反应生成氢氧化铁,FeCl3+3NH3•H2O=Fe(OH)3+3NH4Cl,加热分解得到氧化铁,2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,故C正确;
D.硫化亚铁溶于盐酸,盐酸酸性大于氢硫酸,硫酸亚铁和氢硫酸不能反应,故D错误;
故选C.
点评 本题考查了物质性质、物质转化关系、盐类水解原理等知识点的理解应用,掌握基础是解题关键,题目难度中等.

| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | YX2和WX3均属于离子化合物 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2Y3具有氧化性和还原性 |
| 含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 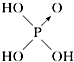 | 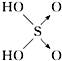 | 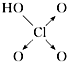 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
①H3PO3的结构式为
 ,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;
,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;②H3AsO3的结构式为
 ,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O. | A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
| A. | 碳氢化合物就是烃 | |
| B. | 水、甲烷和乙烷都是10个电子的分子 | |
| C. | 乙烷的沸点比甲烷高,因而更难液化 | |
| D. | 甲烷和乙烷分子中只有一种氢,故其二氯化物也只有一种 |
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.其操作可分解为如下几步:
a.移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b.用标准盐酸溶液润洗滴定管2-3次
c.把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d.取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e.调节液面至0或0刻度以下,记下读数
f.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)bdceaf.
(2)滴定终点时溶液的颜色变化是浅红色变为无色,且半分钟内不恢复.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若某次滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为20.00 mL.
(5)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
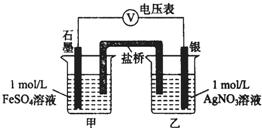 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL1mol/L AgNO3溶液加入到 1mL1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL2mol/LFe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/LFe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL2mol/LFeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4 Ksp(或溶解度)更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.(或AgCl比Ag2SO4 Ksp(或溶解度)更小,促使平衡正向移动,银镜溶解).
| A. | 氢燃料电池汽车的使用可以有效减少城市空气污染 | |
| B. | 电解水制取氢气是理想而经济的制氢方法 | |
| C. | 发展氢燃料电池汽车不需要安全高效的储氢技术 | |
| D. | 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能 |