题目内容
15.取标准状况下甲烷和过量氧气的混合气体840mL,点燃并将燃烧后的气体用过量的碱石灰吸收,碱石灰增重0.600g.计算:碱石灰吸收后所剩气体的体积(标准状况下)分析 石灰增重0.600g生成CO2与H2O的总质量,根据质量守恒,为CH4与反应的O2的总质量,设CH4的物质的量为xmol,根据方程式表示出消耗氧气物质的量,再根据CH4与反应的O2的总质量列方程计算解答.
解答 解:由题知0.600g为生成CO2与H2O的总质量,根据质量守恒,也是CH4与反应的O2的总质量.
设CH4的物质的量为xmol,由CH4+2O2=CO2+2H2O,可知反应氧气的物质的量为2xmol,则:
44x+36x=0.600
解得:x=0.0075
V(CH4)=0.0075mol×22.4L/mol=0.168L=168mL
反应消耗的氧气的体积为:168mL×2=336mL
碱石灰吸收后所剩余的体积为:840mL-168mL-336mL=336mL
答:碱石灰吸收后所剩气体的体积336mL.
点评 本题考查混合物计算,关键是利用质量守恒定律确定参加反应氧气与甲烷总质量,难度中等.

练习册系列答案
相关题目
5.X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,其中只有Z是金属元素,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法中正确的是( )
| X | Y | |||
| W |
| A. | 五种元素中,原子半径最大的是W | |
| B. | Y 的氧化性比W的氧化性强 | |
| C. | Y与Z形成的化合物都可以和水反应 | |
| D. | Z与Q形成的化合物一定是离子化合物 |
6.在以下的分子或离子中,VSEPR模型名称与该粒子的立体构型名称一致的是( )
| A. | NF3 | B. | C${H}_{3}^{-}$ | C. | SO3 | D. | H3O+ |
3.判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.含氧酸酸性强弱与非羟基氧原子数的关系如表所示:
已知:亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推出:
①H3PO3的结构式为 ,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;
,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;
②H3AsO3的结构式为 ,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
| 含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 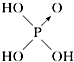 | 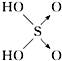 | 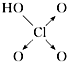 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
①H3PO3的结构式为
 ,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;
,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;②H3AsO3的结构式为
 ,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
10.关于二氧化硫和二氧化氮叙述正确的是( )
| A. | 两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染 | |
| B. | 二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸 | |
| C. | 两种气体都具有强氧化性,因此都能够使品红溶液褪色 | |
| D. | 两种气体溶于水都可以与水反应,且只生成相应的酸 |
20.已知A(g)?B(g)+C(g)△H>0.当反应达到平衡时,下列措施:①升温,②恒容通人惰性气体,③增加B的浓度,④减压,⑤加催化剂,⑥恒压通人惰性气体,能提高A分解率的是( )
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
5. 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
其操作可分解为如下几步:
a.移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b.用标准盐酸溶液润洗滴定管2-3次
c.把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d.取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e.调节液面至0或0刻度以下,记下读数
f.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)bdceaf.
(2)滴定终点时溶液的颜色变化是浅红色变为无色,且半分钟内不恢复.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
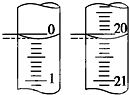
(4)若某次滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为20.00 mL.
(5)某学生根据3次实验分别记录有关数据如下表:
依据上表数据求得NaOH溶液的物质的量浓度为0.0800mol/L(保留4位有效数字).
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.其操作可分解为如下几步:
a.移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b.用标准盐酸溶液润洗滴定管2-3次
c.把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d.取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e.调节液面至0或0刻度以下,记下读数
f.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)bdceaf.
(2)滴定终点时溶液的颜色变化是浅红色变为无色,且半分钟内不恢复.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若某次滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为20.00 mL.
(5)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
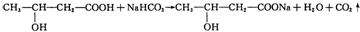 .
. .
.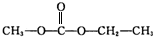 .
.