题目内容
20.已知室温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )| A. | HA电离出的c(H+)与水电离出的c(H+)之比为108 | |
| B. | 升高温度,溶液的pH减小 | |
| C. | 溶液的pH=4 | |
| D. | HA的电离平衡常数约为l×10-7 |
分析 A.HA电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度;
B.温度升高促进电离,氢离子浓度越大,pH越小;
C.利用氢离子的浓度计算pH;
D.根据电离度及离子的浓度计算电离平衡常数.
解答 解:A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢离子浓度为10-10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故A错误;
B.温度升高促进弱酸的电离,氢离子浓度变大,则pH变小,故B正确;
C.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故C正确;
D.由HA?H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故D正确;
故选A.
点评 本题考查弱电解质的电离平衡及其影响,题目难度中等,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.钛(Ti)在生产生活中应用十分广泛,以TiO2制取Ti的主要反应如下:
①TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO; ②TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti
有关说法错误的是( )
①TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO; ②TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti
有关说法错误的是( )
| A. | 反应①是置换反应 | B. | ①②均属于氧化还原反应 | ||
| C. | 每消耗1mol TiO2会生成56g CO | D. | 反应②中镁元素化合价升高 |
7. 实验室保存下列试剂时应使用如图装置的是( )
实验室保存下列试剂时应使用如图装置的是( )
 实验室保存下列试剂时应使用如图装置的是( )
实验室保存下列试剂时应使用如图装置的是( )| A. | 硝酸银固体 | B. | 烧碱溶液 | C. | 浓硝酸 | D. | 氢氟酸 |
8.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
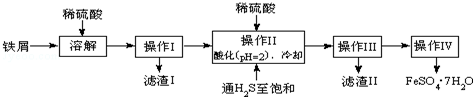
查询资料,得有关物质的数据如下:
(1)写出Fe和Fe2O3在硫酸溶液中发生反应的离子方程式为Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+;
(2)操作Ⅱ中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:6.1×10-15(保留1位小数).

查询资料,得有关物质的数据如下:
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)操作Ⅱ中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:6.1×10-15(保留1位小数).
15.下列说法中正确的是( )
| A. | 配制240mL 0.1mol/LCuSO4溶液需称取胆矾6.3g | |
| B. | 金属氧化物一定是碱性氧化物 | |
| C. | 1L水中溶解58.5g NaCl,该溶液中NaCl的物质的量浓度为1 mol•L-1 | |
| D. | 胶体区别于其他分散系的本质特征是能够产生丁达尔效应 |
12.下列实验设计不能达到实验目的是( )
| 选项 | 实验设计 | 实验目的 |
| A | 过氧化钠与水反应 | 制备少量干燥的氧气 |
| B | 取铁在氧气中充分燃烧后的固体产物溶于稀硫酸,加KSCN溶液 | 检验铁的燃烧产物中含+3价铁 |
| C | 分别取大小相近的钠粒、钾粒投入水中,观察反应的剧烈程度 | 比较钠、钾的还原性强弱 |
| D | 将CO2气体通入Na2SiO3溶液中 | 比较C、Si元素非金属性的强弱 |
| A. | A | B. | B | C. | C | D. | D |
9.某饱和一元醛1.5g和足量的银氨溶液发生银镜反应时,生成21.6g银,则该醛是( )
| A. | 丙醛 | B. | 丁醛 | C. | 3-甲基丁醛 | D. | 甲醛 |
10.向KI、Na2S2O3、淀粉三种物质按一定比例组成的混合溶液中快速加入一定量的(NH4)2S2O8溶液并开始计时,ts时观察到溶液变蓝色,过程中发生下列反应:①2I-+S2O82-=I2+2SO42-(慢),②I2+2S2O32-=2I-+S4O62- (快)下列说法正确的是( )
| A. | 总反应速率由反应②决定 | |
| B. | 在(NH4)2S2O8消耗完后,溶液一定显蓝色 | |
| C. | 若能观察都蓝色出现,刚起始时,n(Na2S2O3)=n[(NH4)2S2O8] | |
| D. | 升高温度,①、②的反应速率均加快 |