题目内容
7. 实验室保存下列试剂时应使用如图装置的是( )
实验室保存下列试剂时应使用如图装置的是( )| A. | 硝酸银固体 | B. | 烧碱溶液 | C. | 浓硝酸 | D. | 氢氟酸 |
分析 实验室中见光易分解的物质,须存放在棕色瓶中,液体需要放在棕色瓶中,据此分别对各物质的性质进行分析选择即可.
解答 解:A.硝酸银固体应放在广口瓶中,故A错误;
B.烧碱溶液能够与玻璃塞中的二氧化硅反应,应该需要橡胶塞,故B错误;
C.浓硝酸见光易分解,须存放在棕色细口瓶中,故C正确;
D.氢氟酸和二氧化硅反应生成四氟化硅,所以不能用玻璃瓶盛放氢氟酸,要用塑料瓶盛放,故D错误.
故选C.
点评 本题以试剂的存放为载体考查了硅酸钠的性质、玻璃的成分等知识点,难度不大,试剂的存放遵循安全性、保纯性、方便性原则,本题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
17.下列变化不属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
15.反应:xA(g)+yB(g)?zC(g),平衡时测得A气体的浓度为0.5mol•L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol•L-1,下列叙述正确的是( )
| A. | x+y<z | B. | 平衡向右移动 | C. | B的转化率升高 | D. | C的体积分数降低 |
2.下列离子方程式改写成化学方程式正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |
20.已知室温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A. | HA电离出的c(H+)与水电离出的c(H+)之比为108 | |
| B. | 升高温度,溶液的pH减小 | |
| C. | 溶液的pH=4 | |
| D. | HA的电离平衡常数约为l×10-7 |
 ;
; ;
;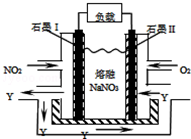 碳和氮的许多化合物在工农业生产和生活中有重要的作用.
碳和氮的许多化合物在工农业生产和生活中有重要的作用.