题目内容
6.钛(Ti)在生产生活中应用十分广泛,以TiO2制取Ti的主要反应如下:①TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO; ②TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti
有关说法错误的是( )
| A. | 反应①是置换反应 | B. | ①②均属于氧化还原反应 | ||
| C. | 每消耗1mol TiO2会生成56g CO | D. | 反应②中镁元素化合价升高 |
分析 A、①反应物有三种物质,所以不是置换反应;
B、①②均有元素化合价的变化;
C、由反应方程式:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,每消耗1mol TiO2会生成2mol的CO;
D、反应②中镁由0价变成+2价.
解答 解:A、①反应物有三种物质,所以不是置换反应,故A错误;
B、①②均有元素化合价的变化,所以都是氧化还原反应,故B正确;
C、由反应方程式:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,每消耗1mol TiO2会生成2mol的CO,质量为:56g,故C正确;
D、反应②中镁由0价变成+2价,所以镁元素化合价升高,故D正确;
故选A.
点评 本题考查氧化还原反应与四种基本反应类型的关系,明确有元素化合价变化的反应属于氧化还原反应即可解答.

练习册系列答案
相关题目
16.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
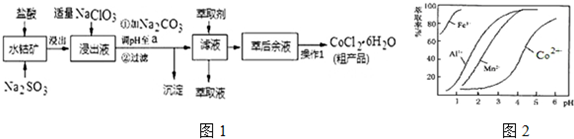
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
17.下列变化不属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
14.下列事实与胶体性质无关的是( )
| A. | 用激光笔照射煮沸过的FeCl3溶液可观察到明亮光路 | |
| B. | 大雾天气用汽车远光灯照射前方常出现明亮光路 | |
| C. | 明矾可用作净水剂 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
1.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | 质量数为16的氧原子:${\;}_{16}^{8}$O | |
| B. | 苛性钠化学式:Na2CO3 | |
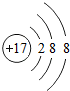
| C. | 镁离子结构示意图: | |
| D. | 次氯酸钠在水中电离:NaClO═Na++Cl-+O2- |
11.下列实验能达到目的是( )
| A. | 用湿润的淀粉碘化钾试纸检验是否有Cl- | |
| B. | 用托盘天平称取12.6g Na2SO4固体粉末 | |
| C. | 通过分液方法分离酒精和水 | |
| D. | 将250g Cu2SO4•5H2O固体溶于1L水,配制1 mol•L-1 CuSO4溶液 |
15.反应:xA(g)+yB(g)?zC(g),平衡时测得A气体的浓度为0.5mol•L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol•L-1,下列叙述正确的是( )
| A. | x+y<z | B. | 平衡向右移动 | C. | B的转化率升高 | D. | C的体积分数降低 |
20.已知室温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A. | HA电离出的c(H+)与水电离出的c(H+)之比为108 | |
| B. | 升高温度,溶液的pH减小 | |
| C. | 溶液的pH=4 | |
| D. | HA的电离平衡常数约为l×10-7 |
 ;
; ;
;