题目内容
1.下列说法正确的是( )| A. | 由一种元素组成的物质一定是单质 | |
| B. | 凡是能电离出H+的化合物都是酸 | |
| C. | 碱能电离出OH-而使溶液显碱性,但溶液显碱性的不一定是碱 | |
| D. | 氨溶于水形成的溶液能导电,所以氨是电解质 |
分析 A.单质是一种元素组成的纯净物;
B.水溶液中电离出的阳离子全部是氢离子的化合物;
C.水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱,盐溶液中弱酸阴离子水解溶液线碱性;
D.水溶液中或熔融状态下导电的化合物为电解质.
解答 解:A、氧气和臭氧组成的混合物由一种元素组成,不是单质,故A错误;
B.电离出阳离子全部是H+的化合物都是酸,酸式盐电离也会电离出氢离子,如NaHSO4,故B错误;
C.碱能电离出OH-而使溶液显碱性,但溶液显碱性的不一定是碱,也可以是盐,故C正确;
D.氨溶于水形成的溶液能导电,是因为氨气和水反应生成了电解质一水合氨,氨气本身不能电离,所以氨是非电解质,故D错误;
故选C.
点评 本题考查了物质分类、酸碱盐概念的实质理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
11.(1)有一学生在实验室测某溶液pH.实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测.
①这种错误操作不一定(填“一定”/“一定不”/“不一定”)会导致实验结果有误差.
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是盐酸.
(2)用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考如图,从表中选出正确序号
(3)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是ADE.
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
①这种错误操作不一定(填“一定”/“一定不”/“不一定”)会导致实验结果有误差.
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是盐酸.
(2)用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考如图,从表中选出正确序号
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |  选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
12.现有200ml.含KNO3和Cu(NO3)2的混合溶液,其中c(NO3- )=3mol•L-l,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况).假定电解后溶液体积仍为200ml),下列说法不正确的是( )
| A. | 电解过程中共转移0.4 mol电子 | B. | 原混合液中c(K+)为2.0 mol•L-l | ||
| C. | 电解得到的Cu的质量为6.4 g | D. | 电解后溶液中c(H+)为0.1 mol•L-l |
9.电动自行车给人们带来了极大的方便,其电池为铅蓄电池,PbO2作为铅蓄电池的重要原料有广泛的用途.己知:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O,下列说法正确的是( )
| A. | PbO2为还原剂,具有还原性 | |
| B. | 氧化产物与还原产物的物质的量之比为5:2 | |
| C. | 生成1mol的Pb2+,转移的电子的物质的量为2mol | |
| D. | 酸性环境下MnO4-具有强氧化性,其氧化性强于PbO2 |
16.质量相同的下列物质中,含分子数最多的是( )
| A. | O3 | B. | CO | C. | Cl2 | D. | NH3 |
6.用NA表示阿伏伽德罗常数的值,则下列说法正确的是( )
| A. | 2NA个H2与O2恰好反应,消耗氧气的体积约是22.4L | |
| B. | 1molC12与足量Fe反应,转移的电子数为3NA | |
| C. | 0.1molNaHSO4固体中,共含有0.2 NA个离子 | |
| D. | 在标准状况下,lLpH=13的NaOH溶液中,含有0.1NA个OH-(不考虑水的电离) |
13.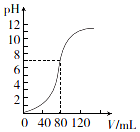 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
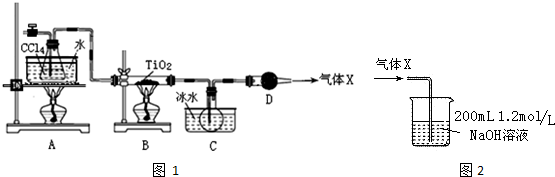
15.TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取.某化学实验小组以8.0g TiO2和足量 CCl4为原料制取TiCl4.装置图1如下:
表是有关物质的性质:
请回答下列问题
(1)TiCl4中化学键的类型是共价键.
(2)B中TiO2发生反应的化学方程式是TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(3)X气体的主要成分是CO2.
(4)实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是排尽系统(装置)中的空气.
(5)欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
(6)若将反应过程中生成的气体X全部通入到图2所示的装置中充分反应,生成的盐是Na2CO3(填化学式),生成盐的总物质的量n≤0.1mol.

表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)TiCl4中化学键的类型是共价键.
(2)B中TiO2发生反应的化学方程式是TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(3)X气体的主要成分是CO2.
(4)实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是排尽系统(装置)中的空气.
(5)欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
(6)若将反应过程中生成的气体X全部通入到图2所示的装置中充分反应,生成的盐是Na2CO3(填化学式),生成盐的总物质的量n≤0.1mol.