题目内容
13.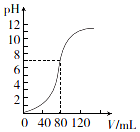 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
分析 根据硫酸溶液的pH确定氢离子浓度,再根据硫酸和氢离子之间的关系式确定硫酸浓度;根据硫酸和氢氧化钠反应的关系式计算氢氧化钠溶液的体积,硫酸和氢氧化钠溶液体积就是完全反应后溶液的总体积.
解答 解:根据图象知,硫酸的pH=0,则c(H+)=1mol/L,c(H2SO4)=$\frac{1}{2}$C(H+)=0.5mol/L;完全反应时氢氧化钠溶液的体积为80mL,根据反应中氢氧化钠和硫酸的关系式得:n(NaOH)=2n(H2SO4)=2×0.5mol/L×0.08L=1mol/L×V,所以V(NaOH)=$\frac{2×0.5mol/L×0.08L}{1mol/L}$=80mL,则混合溶液体积=80mL×2=160mL,
故选A.
点评 本题考查了物质的量的有关计算,根据曲线中pH确定硫酸浓度,再结合硫酸和氢氧化钠的关系式进行解答,难度不大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 放热反应在常温下都很容易发生 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 根据反应物和生成物具有总能量的相对大小可确定反应热 |
4.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 56g金属铁完全反应时失去的电子数为一定为2NA | |
| B. | 18g水所含的电子数目为NA | |
| C. | 在常温常压下,48g氧气和臭氧的混合气体所含的原子数目为3NA | |
| D. | 在常温常压下,11.2L二氧化硫所含的分子数目为0.5 NA |
1.下列说法正确的是( )
| A. | 由一种元素组成的物质一定是单质 | |
| B. | 凡是能电离出H+的化合物都是酸 | |
| C. | 碱能电离出OH-而使溶液显碱性,但溶液显碱性的不一定是碱 | |
| D. | 氨溶于水形成的溶液能导电,所以氨是电解质 |
8.下列诗句或谚语可能与化学反应有关,其中说法正确的是 ( )
| A. | “水乳交融,火上浇油”前者包含物理变化,后者包含化学变化 | |
| B. | “滴水石穿.绳锯木断”不包含化学变化 | |
| C. | “蜡炬成灰泪始干”包含的是物理变化 | |
| D. | 石灰吟中“烈火焚烧若等闲”指的是加热,不包含化学变化 |
10.亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
1测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).NaNO2溶液中c(HNO2)=c(OH-)-c(H+)(用溶液中其它离子的浓度关系式表示).
2沉淀法
取2mL0.1mol/L两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液.两支试管均产生白色沉淀.分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解.该温度下 Ksp(AgNO2)=2×10-8;
Ksp(AgCl)=1.8×10-10则反应AgNO2(s)+Cl-(aq)?AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{1000}{9}$(计算结果写成分数)
(二)实验室可用如下装置(略去部分夹持仪器)制备亚硝酸钠.
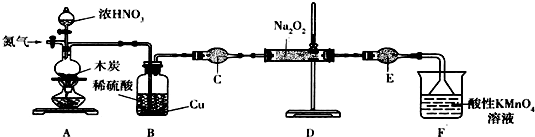
已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3$\frac{\underline{\;加热\;}}{\;}$CO2+4NO2+2H2O.装置B 的作用是将NO2 气体转变为NO,为后面反应提供原料.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(三)测定亚硝酸钠的含量
称取4.000g制取样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一组实验数据出现异常,造成这种异常的原因可能是ac(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O
③根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.(结果保留两位小数)
㈠鉴别NaCl和NaNO2
1测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).NaNO2溶液中c(HNO2)=c(OH-)-c(H+)(用溶液中其它离子的浓度关系式表示).
2沉淀法
取2mL0.1mol/L两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液.两支试管均产生白色沉淀.分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解.该温度下 Ksp(AgNO2)=2×10-8;
Ksp(AgCl)=1.8×10-10则反应AgNO2(s)+Cl-(aq)?AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{1000}{9}$(计算结果写成分数)
(二)实验室可用如下装置(略去部分夹持仪器)制备亚硝酸钠.

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3$\frac{\underline{\;加热\;}}{\;}$CO2+4NO2+2H2O.装置B 的作用是将NO2 气体转变为NO,为后面反应提供原料.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(三)测定亚硝酸钠的含量
称取4.000g制取样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 次数 | 2 | 3 | ||
| KMnO体积/m | 20.60 | 20.02 | 20.00 | 9.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O
③根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.(结果保留两位小数)
8.下列图示与对应的叙述相符的是( )
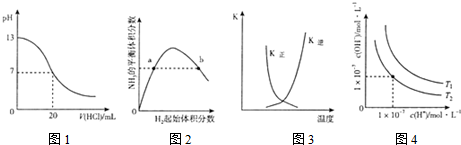

| A. | 图1表示25℃时,用0.lmol L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 | |
| C. | 图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图4表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 |
 在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).
在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).