题目内容
15.一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)?Ba2+(aq)+2OH-(aq) 向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是( )| A. | c(Ba2+)浓度增大 | B. | 溶液中Ba2+数目减少 | ||
| C. | 溶液pH减小 | D. | 溶液pH增大 |
分析 向悬浊液中加少量BaO,发生:BaO+H2O=Ba(OH)2,消耗水,溶液中c(Ba2+)、c(OH-)增大,由于原溶液已达到饱和,则沉淀溶解平衡向逆反应方向移动,故各离子的数目减少,但是饱和溶液的浓度只与温度有关,故浓度保持不变.
解答 解:向悬浊液中加少量BaO,发生:BaO+H2O=Ba(OH)2,消耗水,因为Ba(OH)2的悬浊液,则溶液中浓度不变,因水减少,则析出Ba(OH)2,溶液中Ba2+数目减少,pH不变,只有B正确.
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度一般,要注意向悬浊液中加少量BaO,发生的反应:BaO+H2O=Ba(OH)2,从平衡移动的角度分析.

练习册系列答案
相关题目
20.氯碱工业是以电解饱和食盐水为基础的工业.饱和食盐水是以含Ca2+、Mg2+、SO42-、Fe3+等杂质离子的粗盐水精制,需要使用的药品包括:①稀盐酸 ②烧碱溶液 ③碳酸钠溶液 ④氯化钡溶液.下列有关说法不正确的是( )
| A. | 加入烧碱溶液主要是除去Mg2+、Fe3+ | |
| B. | 药品加入的先后顺序可以是②③④① | |
| C. | 加入稀盐酸主要是除去所加过量物质中的OH-、CO32- | |
| D. | 加入碳酸钠溶液主要是除去Ca2+及所加过量物质中的Ba2+ |
1.向含有c(FeCl3)=0.2mol•L-1、c(FeCl2)=0.1mol•L-1的混合溶液中滴加稀NaOH溶液可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na分离开 | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 当光束通过该分散系时,可以看到一条光亮的“通路” |
3.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如右图所示.下列说法正确的是( )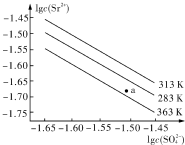

| A. | 温度一定时,KSP(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时KSP(SrSO4)最大 | |
| C. | 283K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
10.已知:Ksp(CuS)=1.3×10-36mol2/L2,Ksp(MnS)=2.6×10-13mol2/L2.工业生产中常用MnS作为沉淀剂 除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法错误的是( )
| A. | MnS使用量越大,废水中的Cu2+的去除率越高 | |
| B. | 该反应可将工业废水中的Cu2+沉淀完全 | |
| C. | 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 | |
| D. | 该反应的平衡常数K=2.0×1023 |
20.已知在25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列说法错误的是( )
| A. | 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小 | |
| B. | 由于Ksp(AgCl)>Ksp(AgI),AgCl 沉淀在一定条件下可转化为AgI沉淀 | |
| C. | 在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大 | |
| D. | 向等浓度的NaCl和NaI混合溶液中逐滴加入AgNO3溶液,先出现AgI沉淀 |
 某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中. .
.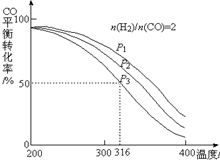 利用CO和H2还可以制备二甲醚.将合成气以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如右图所示,下列说法不正确的是B.
利用CO和H2还可以制备二甲醚.将合成气以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如右图所示,下列说法不正确的是B.