题目内容
4.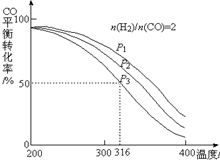 利用CO和H2还可以制备二甲醚.将合成气以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如右图所示,下列说法不正确的是B.
利用CO和H2还可以制备二甲醚.将合成气以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如右图所示,下列说法不正确的是B.A.△H<0
B.P1<P2<P3
C.若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率大于50%
分析 A.由图可知,压强一定时,温度越高,平衡时CO的转化率越低,说明升高温度平衡向逆反应方向移动;
B.正反应为气体体积减小的反应,温度一定时,增大压强平衡向正反应方向移动,CO的转化率增大;
C.增大某一反应物的浓度,平衡向正反应方向移动,其它反应物的转化率增大,自身转化率降低.
解答 解:A.由图可知,压强一定时,温度越高,平衡时CO的转化率越低,说明升高温度平衡向逆反应方向移动,故正反应为放热反应,即△H<0,故A正确;
B.由图可知转化率P1>P2>P3,正反应为气体体积减小的反应,温度一定时,增大压强平衡向正反应方向移动,CO的转化率增大,故压强P1>P2>P3,故B错误;
C.若在P3和316℃时,起始时n(H2):n(CO)=3,相当于在原平衡的基础上增大氢气的浓度,平衡向正反应方向移动,CO的转化率增大,故CO转化率应大于50%,故C正确;
故答案为:B.
点评 本题考查了化学平衡的影响因素及应用,题目难度不大,明确化学平衡及其影响为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)?Ba2+(aq)+2OH-(aq) 向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是( )
| A. | c(Ba2+)浓度增大 | B. | 溶液中Ba2+数目减少 | ||
| C. | 溶液pH减小 | D. | 溶液pH增大 |
12.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应过程中测定的部分数据见下表(表中t1<t2).下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.4}{{t}_{1}}$mol.L-1.min-1 | |
| B. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,若向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO和H2O的转化率均增大 | |
| D. | 保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20 mol H2O,则到达平衡时,n(CO2)=0.40 mol |
19.已知2A2(g)+B2(g)?2C3(g)△H=-a kJ/mol(a>0),在一个有催化剂,固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为x mol/L,放出的热量为bkJ.
(1)a>b(填“>”、“<”或“=”).
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”、“<”或“=”).
若在原来容器内,只加入2molC3,500℃时充分反应达到平衡后,吸收热量c kJ,则C3的浓度=x mol/L(填“>”、“<”或“=”),a、b、c之间满足何种关系a=b+c
a=b+c(用代数式表示).
(3)在相同条件下要想得到2a kJ的热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2 和2molC3
A.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量为d kJ,则d>b(填“>”、“<”或“=”),理由是恒压容器压强保持不变,随着反应的进行容器体积减小,平衡向正反应方向移动,故放出较多热量.
(1)a>b(填“>”、“<”或“=”).
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”、“<”或“=”).
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
a=b+c(用代数式表示).
(3)在相同条件下要想得到2a kJ的热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2 和2molC3
A.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量为d kJ,则d>b(填“>”、“<”或“=”),理由是恒压容器压强保持不变,随着反应的进行容器体积减小,平衡向正反应方向移动,故放出较多热量.
9.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应.下列说法中,正确的是( )
| A. | 达到化学平衡时,正反应速率与逆反应速率不相等 | |
| B. | 反应过程中,Y的单质的体积分数始终为50% | |
| C. | 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1 | |
| D. | 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小 |
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.