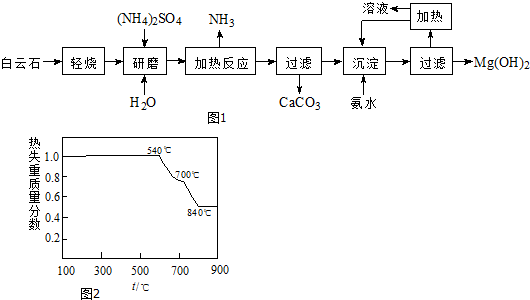
题目内容
10.已知:Ksp(CuS)=1.3×10-36mol2/L2,Ksp(MnS)=2.6×10-13mol2/L2.工业生产中常用MnS作为沉淀剂 除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法错误的是( )| A. | MnS使用量越大,废水中的Cu2+的去除率越高 | |
| B. | 该反应可将工业废水中的Cu2+沉淀完全 | |
| C. | 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 | |
| D. | 该反应的平衡常数K=2.0×1023 |
分析 对于反应Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),平衡常数K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$=$\frac{c(M{n}^{2+})•c({S}^{2-})}{c(C{u}^{2+})•c({S}^{2-})}$=$\frac{Ksp(MnS)}{Ksp(CuS)}$,结合浓度对平衡移动的影响解答该题.
解答 解:A.MnS为固体,难溶于水,则大使用量,如浓度不变,则平衡不移动,故A错误;
B.加入MnS,溶液中c(S2-)=$\sqrt{26}$×10-6mol/L,则c(Cu2+)=$\frac{1.3×1{0}^{-36}}{\sqrt{26}×1{0}^{-6}}$mol/L<×10-5mol/L,则Cu2+沉淀完全,故B正确;
C.增大铜离子的浓度,平衡正向移动,所以c(Mn2+)变大,故C正确;
D.反应的平衡常数K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$=$\frac{c(M{n}^{2+})•c({S}^{2-})}{c(C{u}^{2+})•c({S}^{2-})}$=$\frac{Ksp(MnS)}{Ksp(CuS)}$=$\frac{2.6×1{0}^{-13}}{1.3×1{0}^{-36}}$=2.0×1023,故D正确.
故选A.
点评 本题主要考查了沉淀的平衡以及转化,为高频考点,侧重考查学生的分析能力和计算能的考查,难度不大,注意把握平衡移动原理以及沉淀转化,把握相关计算公式的运用.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
15.在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )
| A. | 乙烯 乙二醇: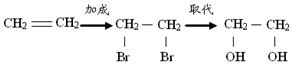 | |
| B. | 溴乙烷 乙醇:CH3CH2Br$\stackrel{水解}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷 1,3-丁二烯: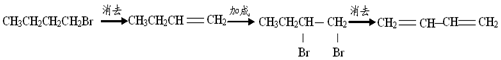 | |
| D. | 乙烯 乙炔: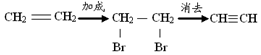 |
16.下列叙述正确的是( )
| A. | 4g氢气中含有的原子数是2mol | |
| B. | 4g氢气所占的体积是44.8L | |
| C. | 4g氢气的物质的量是2mol | |
| D. | 4g氢气与44.8L氧气所占有的体积相同 |
13.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g)平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的三倍,再达平衡时,测得A的浓度降低为0.15mol/L.下列有关判断错误的是( )
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
5.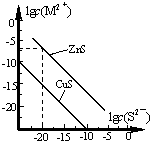 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时,Ksp(CuS)约为1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+浓度均为10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5 mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |
15.一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)?Ba2+(aq)+2OH-(aq) 向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是( )
| A. | c(Ba2+)浓度增大 | B. | 溶液中Ba2+数目减少 | ||
| C. | 溶液pH减小 | D. | 溶液pH增大 |
19.已知2A2(g)+B2(g)?2C3(g)△H=-a kJ/mol(a>0),在一个有催化剂,固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为x mol/L,放出的热量为bkJ.
(1)a>b(填“>”、“<”或“=”).
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”、“<”或“=”).
若在原来容器内,只加入2molC3,500℃时充分反应达到平衡后,吸收热量c kJ,则C3的浓度=x mol/L(填“>”、“<”或“=”),a、b、c之间满足何种关系a=b+c
a=b+c(用代数式表示).
(3)在相同条件下要想得到2a kJ的热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2 和2molC3
A.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量为d kJ,则d>b(填“>”、“<”或“=”),理由是恒压容器压强保持不变,随着反应的进行容器体积减小,平衡向正反应方向移动,故放出较多热量.
(1)a>b(填“>”、“<”或“=”).
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”、“<”或“=”).
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
a=b+c(用代数式表示).
(3)在相同条件下要想得到2a kJ的热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2 和2molC3
A.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量为d kJ,则d>b(填“>”、“<”或“=”),理由是恒压容器压强保持不变,随着反应的进行容器体积减小,平衡向正反应方向移动,故放出较多热量.
20.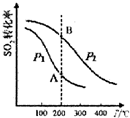 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.
(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0
SO2的平衡转化率与温度、压强的关系如图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如表所示:
计算上述反应在0~10min内,v(O2)=0.08mol•L-1•min-1.
能说明该反应达到化学平衡状态的是d(填序号).
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O=2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0
SO2的平衡转化率与温度、压强的关系如图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是d(填序号).
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O=2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.