题目内容
3.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如右图所示.下列说法正确的是( )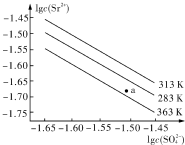
| A. | 温度一定时,KSP(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时KSP(SrSO4)最大 | |
| C. | 283K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
分析 沉淀溶解平衡中的溶度积常数只与温度有关,与浓度改变无关;溶解度随温度变化而变化,也随离子浓度改变;硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线,纵轴是锶离子浓度的对数,横轴是硫酸根离子浓度的对数,由图可知,浓度越大,对数值越大,以此解答该题.
解答 解:A.Ksp只与温度有关与浓度无关,故A错误;
B.由图象可知313K时离子浓度最大,则313K时KSP(SrSO4)最大,故B正确;
C.a点在平衡线一下,说明为不饱和溶液,故C错误;
D.由图象可知363K时的Ksp最小,则283K下的SrSO4饱和溶液升温到363K后仍为饱和溶液,故D错误.
故选B.
点评 本题考查沉淀溶解平衡及Ksp的意义和应用,为高频考点,侧重于学生的分析能力的考查,本题注意把握图象中纵坐标和横坐标的意义,理解曲线的变化趋势,难度不大.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
8.某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )
| A. | Cl-、Fe3+ | B. | HCO3-、Al3+ | C. | Ba2+、SO42- | D. | Na+、SO42- |
13.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g)平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的三倍,再达平衡时,测得A的浓度降低为0.15mol/L.下列有关判断错误的是( )
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
8.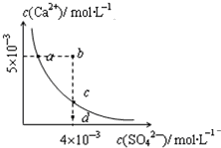 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )| A. | CaSO4溶解在水中,c(Ca2+)=c(SO42-)=3×10-3mol/L | |
| B. | 在d点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3mol/L |
15.一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)?Ba2+(aq)+2OH-(aq) 向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是( )
| A. | c(Ba2+)浓度增大 | B. | 溶液中Ba2+数目减少 | ||
| C. | 溶液pH减小 | D. | 溶液pH增大 |
12.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应过程中测定的部分数据见下表(表中t1<t2).下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.4}{{t}_{1}}$mol.L-1.min-1 | |
| B. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,若向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO和H2O的转化率均增大 | |
| D. | 保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20 mol H2O,则到达平衡时,n(CO2)=0.40 mol |