题目内容
5.在10L密闭的容器中充入2molA和1molB,发生的化学反应为:3A(g)+B(g)?xC(g)+2D(g),2min后反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的$\frac{5}{6}$,试填写下列空白:(1)x的值为1
(2)写出该反应的化学平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{{c}^{3}(A)•c(B)}$
(3)平衡时,A的浓度为0.05mol/L
(4)用气体B表示的2min内的平均反应速率为0.025mol.L-1.min-1.
分析 (1)恒温恒容下,气体的压强与气体体积成正比,测得平衡时容器内气体的压强比反应前小,说明是体积减小的反应;x只能为1;
(2)根据化学平衡常数概念得表达式;
(3)根据三段式可得平衡时的各物质的浓度;
(4)根据反应速率v=$\frac{△c}{△t}$计算.
解答 解:(1)恒温恒容下,气体的压强与气体体积成正比,测得平衡时容器内气体的压强是反应前的$\frac{5}{6}$,说明平衡时容器内气体的压强比反应前小,说明是体积减小的反应,x只能为1;
故答案为:1
(2)化学平衡常数为生成物的浓度幂之积与反应物浓幂之积,则k=$\frac{c(C)•{c}^{2}(D)}{{c}^{3}(A)•c(B)}$;
故答案为:$K=\frac{{c(C)•{c^2}(D)}}{{{c^3}(A)•c(B)}}$
(3)设反应A3amol,根据三段式:
3A(g)+B(g)?C(g)+2D(g)
起始量:2 1 0 0
转化量:3a a a 2a
平衡量:2-3a 1-a a 2a
则有:$\frac{2-3a+1-a+a+2a}{2+1}$=$\frac{5}{6}$,得a=0.5mol,所以平衡时a的浓度为:$\frac{(2-3×0.5)mol}{10L}$=0.05mol/L;
故答案为:0.05
(4)B的反应速率为:$\frac{0.5mol÷10L}{2min}$=0.025mol.L-1.min-1;
故答案为:0.025mol.L-1.min-1
点评 本题考查了化学平衡计算的分析应用,主要是反应速率、转化率、平衡常数的概念计算,掌握基础是关键,题目难度中等,注意速率的单位.

| A. | c(Ba2+)浓度增大 | B. | 溶液中Ba2+数目减少 | ||
| C. | 溶液pH减小 | D. | 溶液pH增大 |
 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0
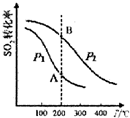
SO2的平衡转化率与温度、压强的关系如图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是d(填序号).
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O=2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为226.3kJ.
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.
实验结果如图1所示:(图中T表示温度,n表示物质的量)
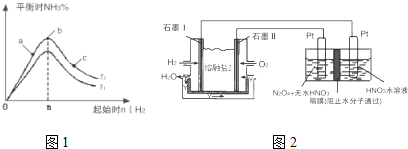
①图象中T2和T1的关系是:T2低于T1(填“高于”、“低于”、“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
③在起始体系中加入N2的物质的量为$\frac{n}{3}$mol时,反应后氨的百分含量最大; 若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=2.08.
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)?4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
在电解池中生成N2O5的电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.

| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应 | |
| C. | 1molM与热的烧碱溶液反应,可消耗2nmol的NaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
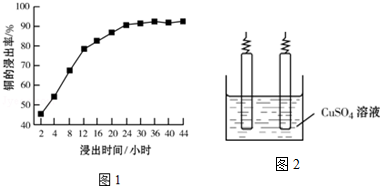
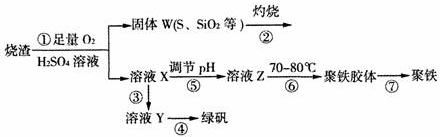
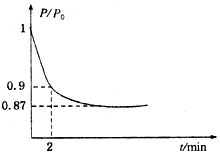 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.