题目内容
碳酸氢铵、硫酸铵均是我国主要的氮肥品种,碳酸氢铵在贮存和运输过程中容易挥发损失.为了鉴定其质量和确定田间施用量,必须测定其含氮量.
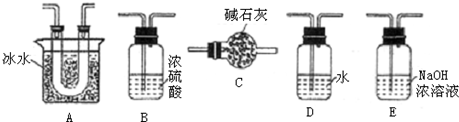
I.某学生欲测定碳酸氢铵化肥中的含氮量,选用下列装置通过测定生成二氧化碳的量间接测出化肥的含氮量.
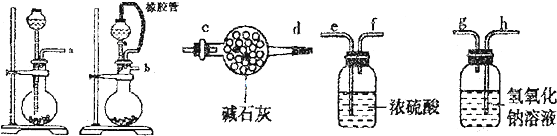
(1)请选择必要的装置(每个装置最多使用一次),按气流方向连接顺序为 组装好装置,连在最后的装置起到的 作用.
(2)检验气密性后,将样品放入圆底烧瓶中,滴加液体.该液体最适合的是 .
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化纳
Ⅱ.如果氮肥中成分是硫酸铵,则可以用甲醛法测定含氮量,反应为:2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4再将生成的酸用氢氧化钠标准溶液滴定,从而测出氮的含量.步骤如下:
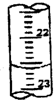
(3)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加蒸馏水溶解配成100mL溶液,准确量取20.00mL的待测液溶液于锥形瓶中,加入适量l8%的中性甲醛,放置5min后,加入1-2滴 指示剂(已知滴定终点的pH约为8.8),用浓度为0.0800mol/L氢氧纯钠标准溶液滴定至终点.再重复滴定2次,三次滴定的读数如下表:
计算出该样品中的氮的质量分数为 .
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值 (填”偏大“偏小”或“无影响”).
(5)如果测定碳酸氢铵化肥中的含氮量时,也使用甲醛法是否合理 (填“是”或“否”),理由是 .
I.某学生欲测定碳酸氢铵化肥中的含氮量,选用下列装置通过测定生成二氧化碳的量间接测出化肥的含氮量.

(1)请选择必要的装置(每个装置最多使用一次),按气流方向连接顺序为
(2)检验气密性后,将样品放入圆底烧瓶中,滴加液体.该液体最适合的是
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化纳
Ⅱ.如果氮肥中成分是硫酸铵,则可以用甲醛法测定含氮量,反应为:2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4再将生成的酸用氢氧化钠标准溶液滴定,从而测出氮的含量.步骤如下:
(3)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加蒸馏水溶解配成100mL溶液,准确量取20.00mL的待测液溶液于锥形瓶中,加入适量l8%的中性甲醛,放置5min后,加入1-2滴
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值
(5)如果测定碳酸氢铵化肥中的含氮量时,也使用甲醛法是否合理
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:I.(1)根据反应装置--干燥装置--吸收装置-尾气处理装置排序;空气中的水和二氧化碳影响实验结果;
(2)盐酸和硝酸都具有挥发性;
II.(3)酸式滴定管只能量取酸性溶液,碱式滴定管只能量取碱性溶液,根据溶液的酸碱性确定滴定管;根据滴定终点确定指示剂;滴定终点时溶液从无色变为浅红色,30s内不褪色;
根据氢氧化钠和硫酸铵的关系式计算硫酸铵的量,最后再计算N元素的含量;
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致硫酸铵的测定结果偏小;
(5)碳酸氢钠和氢氧根离子反应生成碳酸根离子和水.
(2)盐酸和硝酸都具有挥发性;
II.(3)酸式滴定管只能量取酸性溶液,碱式滴定管只能量取碱性溶液,根据溶液的酸碱性确定滴定管;根据滴定终点确定指示剂;滴定终点时溶液从无色变为浅红色,30s内不褪色;
根据氢氧化钠和硫酸铵的关系式计算硫酸铵的量,最后再计算N元素的含量;
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致硫酸铵的测定结果偏小;
(5)碳酸氢钠和氢氧根离子反应生成碳酸根离子和水.
解答:
解:I.(1)根据反应装置--干燥装置--吸收装置-尾气处理装置排序,所以其排列顺序是:b-e-f-h-g-c,为防止影响实验结果,需要吸收二氧化碳和水蒸气,故答案为:b-e-f-h-g-c;防止空气中水和二氧化碳进入装置影响实验结果;
(2)制取二氧化碳时需要碳酸盐和酸反应,稀盐酸、浓硝酸都具有挥发性,影响实验结果,氢氧化钠和盐不能生成二氧化碳,故选B;
II.(3)因为滴定终点的pH约为8.8,酚酞的变色范围是8-10,所以选取酚酞作指示剂;
2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4+6H2O、2NaOH+H2SO4=Na2SO4+2H2O,所以硫酸铵和NaOH的关系式为:(NH4)2SO4~2NaOH,NaOH溶液的平均体积=
mL=15.3mL,根据(NH4)2SO4~2NaOH得m[(NH4)2SO4]=
=0.0808g,0.6g硫酸铵中硫酸铵的质量=0.0808g×5=0.404g,
氮元素的质量分数=
=14%,
故答案为:酚酞;14%;
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致NaOH溶液的量偏小,根据(NH4)2SO4---2NaOH得,导致测定N含量偏小,故答案为:偏小;
(5)因为氢氧化钠除了与生成的酸反应,还会和溶液中的碳酸氢根离子反应生成碳酸钠,所以会导致测量结果偏大,故答案为:否;用氢氧化钠标准溶液滴定时,溶液中HCO3-也会和氢氧化钠中和.
(2)制取二氧化碳时需要碳酸盐和酸反应,稀盐酸、浓硝酸都具有挥发性,影响实验结果,氢氧化钠和盐不能生成二氧化碳,故选B;
II.(3)因为滴定终点的pH约为8.8,酚酞的变色范围是8-10,所以选取酚酞作指示剂;
2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4+6H2O、2NaOH+H2SO4=Na2SO4+2H2O,所以硫酸铵和NaOH的关系式为:(NH4)2SO4~2NaOH,NaOH溶液的平均体积=
| (16.21-1.20)+(18.90-3.00)+(19.49-4.50) |
| 3 |
| 0.0153L×0.08mol/L |
| 2 |
氮元素的质量分数=
0.404g×
| ||
| 0.6g |
故答案为:酚酞;14%;
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致NaOH溶液的量偏小,根据(NH4)2SO4---2NaOH得,导致测定N含量偏小,故答案为:偏小;
(5)因为氢氧化钠除了与生成的酸反应,还会和溶液中的碳酸氢根离子反应生成碳酸钠,所以会导致测量结果偏大,故答案为:否;用氢氧化钠标准溶液滴定时,溶液中HCO3-也会和氢氧化钠中和.
点评:本题考查了物质含量的测定,明确实验原理是解本题关键,根据物质间的反应结合实验操作进行解答,此种类型的题阅读量较大,同时考查书写获取信息、加工信息的能力,注意II(4)中酸碱指示剂的选取方法,注意取用的溶液为配制溶液的五分之一,不是全部溶液,为易错点.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列说法不正确的是( )
| A、复分解反应一定不是氧化还原反应 |
| B、置换反应一定是氧化还原反应 |
| C、有单质参加的化合反应一定是氧化还原反应 |
| D、没有单质生成的分解反应一定不是氧化还原反应 |
我国科学家在世界上首次合成了三种新核素,其中一种新核素是185Hf(铪).关于185Hf的下列说法中,正确的是( )
| A、是一种新元素 |
| B、原子核内有185个质子 |
| C、原子核内有185个中子 |
| D、是183Hf的一种新的同位素 |
 某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
 ;
; +RCl→NaCl+
+RCl→NaCl+