题目内容
下列说法不正确的是( )
| A、复分解反应一定不是氧化还原反应 |
| B、置换反应一定是氧化还原反应 |
| C、有单质参加的化合反应一定是氧化还原反应 |
| D、没有单质生成的分解反应一定不是氧化还原反应 |
考点:氧化还原反应,化学基本反应类型
专题:
分析:根据四大基本反应类型的特点和氧化还原反应是有化合价变化的反应来回答.
解答:
解:A、复分解反应中一定没有元素化合价的变化,该反应一定不是氧化还原反应,故正确;
B、置换反应一定存在化合价的变化,均是氧化还原反应,故B正确;
C、有单质参加的化合反应,单质的化合价一定发生变化,属于氧化还原反应,故C正确;
D、没有单质生成的分解反应也可能存在化合价的变化,如:NH4NO3
N2O↑+2H2O,属于还原反应,故D错误.
故选D.
B、置换反应一定存在化合价的变化,均是氧化还原反应,故B正确;
C、有单质参加的化合反应,单质的化合价一定发生变化,属于氧化还原反应,故C正确;
D、没有单质生成的分解反应也可能存在化合价的变化,如:NH4NO3
| ||
故选D.
点评:本题考查学生氧化还原反应和四大基本反应类型之间的关系,注意把握氧化还原反应的特征,题目较简单.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、滴入酚酞显红色的溶液:Na+、Mg2+、NO3-、HSO3- |
| B、0.1 mol?L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl- |
| C、0.1 mol?L-1氨水溶液:K+、Na+、NO3-、AlO2- |
| D、由水电离出的c(H+)=10-11mol?L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)
xC(g),符合下图甲所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).则图乙中y轴是指( )

xC(g),符合下图甲所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).则图乙中y轴是指( )

| A、C的转化率 |
| B、平衡混合气中B的百分含量 |
| C、平衡混合气的平均相对分子质量 |
| D、平衡混合气的密度 |
下列热化学方程式正确的是( )
| A、2SO2+O2?2SO3;△H=-196.6 kJ?mol-1 | ||
B、H2 (g)+
| ||
| C、2H2 (g)+O2 (g)=2H2O(l);△H=-571.6 kJ | ||
| D、C(s)+O2 (g)=CO2 (g);△H=+393.5 kJ?mol-1 |
下列说法正确的是( )
| A、化学键断裂的过程是吸收能量的过程 |
| B、水分解产生氢气和氧气时放出能量 |
| C、需要加热的反应就是吸热反应 |
| D、并不是所有的化学反应都伴随着能量变化 |
下列各项内容中,排列顺序正确的是( )
①氧化性:KMnO4>MnO2>Cl2
②单质的密度:Na<K<Rb
③微粒半径:K+>S2->F
④物质的熔点:Li>Na>K
⑤氢化物的沸点:H2Se>H2S>H2O.
①氧化性:KMnO4>MnO2>Cl2
②单质的密度:Na<K<Rb
③微粒半径:K+>S2->F
④物质的熔点:Li>Na>K
⑤氢化物的沸点:H2Se>H2S>H2O.
| A、①③ | B、②④ | C、①④ | D、③⑤ |
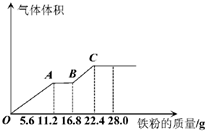 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析错误的是( )| A、AB段的反应为:Fe+2Fe3+=3Fe2+ |
| B、第二份溶液中最终溶质为FeSO4 |
| C、混合酸中NO3-物质的量为0.4mol |
| D、混合酸中H2SO4浓度为5mol?L-1 |
下列溶液中,Cl-的物质的量浓度与50mL 1mol?L-1AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A、50 mL 1 mol?L-1KCl溶液 |
| B、25 mL 2 mol?L-1Ca(Cl)2溶液 |
| C、150 mL 3 mol?L-1KCl溶液 |
| D、50 mL 1 mol?L-1 MgCl2溶液 |