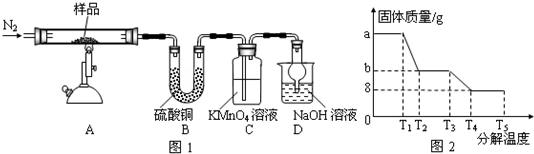
题目内容
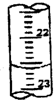 某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ,用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号)
②步骤Ⅳ中滴定时眼睛应
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
②烧碱样品的纯度为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据配制一定物质的量浓度的溶液的配制步骤选择使用的仪器;
(2)①盛标准液的酸式滴定管必须润洗,否则量取的溶液浓度偏低;
②滴定时眼睛注视锥形瓶中颜色变化;根据待测液中加入酚酞,溶液为红色,中和反应结束,溶液颜色消失进行判断;
③滴定前仰视,导致读数偏大;滴定后俯视会导致读数偏小;
(3)先分析数据的有效性,依据滴定管读数读出消耗溶液最后的体积,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量,再计算烧碱样品的纯度.
(2)①盛标准液的酸式滴定管必须润洗,否则量取的溶液浓度偏低;
②滴定时眼睛注视锥形瓶中颜色变化;根据待测液中加入酚酞,溶液为红色,中和反应结束,溶液颜色消失进行判断;
③滴定前仰视,导致读数偏大;滴定后俯视会导致读数偏小;
(3)先分析数据的有效性,依据滴定管读数读出消耗溶液最后的体积,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量,再计算烧碱样品的纯度.
解答:
解:(1)用2.50g含有少量杂质的固体烧碱样品配制500mL溶液,配制过程为:计算、称量、溶解、冷却、转移、洗涤、摇匀等,需要的仪器有托盘天平、烧杯、玻璃棒、量筒、500mL容量瓶、胶头滴管,需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要量筒和500mL容量瓶,
故答案为:500mL容量瓶、量筒;
(2)①用蒸馏水洗涤酸式滴定管,然后必须对酸式滴定管用标准液进行润洗,否则会导致标准液浓度减小,得到时消耗的标准液体积增大,测定结果偏大,
故答案为:Ⅰ; 偏大;
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化;锥形瓶中滴入酚酞后,溶液为红色,随着反应进行,当氢氧化钠与盐酸恰好反应,溶液的颜色会消失,所以达到终点现象为:溶液红色褪去,且30秒内不变色,
故答案为:观察锥形瓶中溶液颜色的变化;溶液红色褪去,且半分钟内不变色;
③步骤II中仰视读数,会导致滴定管的读数偏大;步骤Ⅳ中俯视读数,会导致滴定管读数偏小,最终导致消耗的盐酸体积偏小,测定结果偏低,
故答案为:偏小;
(3)三次消耗盐酸体积分别为:20.38mL-0.20mL=20.18mL、24.20mL-4.00mL=20.20mL、a=22.6mL,22.6mL-2.38mL=20.22mL,三次滴定数据都是有效的,三次消耗盐酸的平均体积为:
=20.20mL,
根据关系式NaOH~HCl可知,n(NaOH)=n(HCl)=0.1000mol?L-1×0.022mL=0.00202mol,
所以20.00mL待测溶液含有:m(烧碱)═n?M═0.00202mol×40g/mol=0.808g,
所以1000mL待测溶液含有m(烧碱)═0.808g×
=2.02g,
烧碱的纯度ω(烧碱)=
×100%=80.8%,
故答案为:22.60,80.8%.
故答案为:500mL容量瓶、量筒;
(2)①用蒸馏水洗涤酸式滴定管,然后必须对酸式滴定管用标准液进行润洗,否则会导致标准液浓度减小,得到时消耗的标准液体积增大,测定结果偏大,
故答案为:Ⅰ; 偏大;
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化;锥形瓶中滴入酚酞后,溶液为红色,随着反应进行,当氢氧化钠与盐酸恰好反应,溶液的颜色会消失,所以达到终点现象为:溶液红色褪去,且30秒内不变色,
故答案为:观察锥形瓶中溶液颜色的变化;溶液红色褪去,且半分钟内不变色;
③步骤II中仰视读数,会导致滴定管的读数偏大;步骤Ⅳ中俯视读数,会导致滴定管读数偏小,最终导致消耗的盐酸体积偏小,测定结果偏低,
故答案为:偏小;
(3)三次消耗盐酸体积分别为:20.38mL-0.20mL=20.18mL、24.20mL-4.00mL=20.20mL、a=22.6mL,22.6mL-2.38mL=20.22mL,三次滴定数据都是有效的,三次消耗盐酸的平均体积为:
| 20.18ml+20.20ml+20.22ml |
| 3 |
根据关系式NaOH~HCl可知,n(NaOH)=n(HCl)=0.1000mol?L-1×0.022mL=0.00202mol,
所以20.00mL待测溶液含有:m(烧碱)═n?M═0.00202mol×40g/mol=0.808g,
所以1000mL待测溶液含有m(烧碱)═0.808g×
| 500ml |
| 20ml |
烧碱的纯度ω(烧碱)=
| 2.02g |
| 2.5g |
故答案为:22.60,80.8%.
点评:本题考查中和滴定及配制一定物质的量浓度的溶液仪器选择,注意在酸碱中和滴定时,左手控制活塞或玻璃小球、右手摇动锥形瓶、眼睛注视锥形瓶中颜色变化,本题难度中等.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
下列热化学方程式正确的是( )
| A、2SO2+O2?2SO3;△H=-196.6 kJ?mol-1 | ||
B、H2 (g)+
| ||
| C、2H2 (g)+O2 (g)=2H2O(l);△H=-571.6 kJ | ||
| D、C(s)+O2 (g)=CO2 (g);△H=+393.5 kJ?mol-1 |
下列溶液中,Cl-的物质的量浓度与50mL 1mol?L-1AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A、50 mL 1 mol?L-1KCl溶液 |
| B、25 mL 2 mol?L-1Ca(Cl)2溶液 |
| C、150 mL 3 mol?L-1KCl溶液 |
| D、50 mL 1 mol?L-1 MgCl2溶液 |
下列是有关实验操作的步骤和做法,不正确的是( )
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部 |
有A、B、C、D四个反应的焓变和熵变如表所示:下列说法正确的是( )
| 反应 | A | B | C | D |
| △H/kJ?mol-1 | 10.5 | 1.80 | -126 | -11.7 |
| △S/kJ?mol-1?k-1 | 30.0 | -113.0 | 84.0 | -105.0 |
| A、反应A在任何温度下均可自发进行 |
| B、反应B在任何温度下均不可自发进行 |
| C、反应C必须在温度高于170℃时才能自发进行 |
| D、反应D在任何温度下均不可自发进行 |